30/09/2011
Применение коэнзима Q10 в педиатрии: от науки к практике
Одним из важнейших аспектов изучения генеза целого ряда заболеваний является исследование состояния биологических мембран. Основным процессом, приводящим к их деструкции, является свободнорадикальное перекисное окисление липидов (ПОЛ).
Одним из важнейших аспектов изучения генеза целого ряда заболеваний является исследование состояния биологических мембран. Основным процессом, приводящим к их деструкции, является свободнорадикальное перекисное окисление липидов (ПОЛ). Известно, что ПОЛ – важнейший и многогранный биохимический процесс, который в зависимости от концентрации образовавшихся активных форм кислорода (АФК) может оказывать прямо противоположные биологические эффекты: при нормальной концентрации – регуляторный, обеспечивающий нормальную жизнедеятельность клеток и организма в целом, при избыточной концентрации – токсический.
Современные достижения в изучении клеточных структур различных органов указывают на ведущую роль оксидативного стресса (избыточного образования АФК) в формировании патологии желудочно-кишечного тракта (ЖКТ), мочевой, сердечно-сосудистой и других систем в организме. Особую опасность избыточное, неконтролируемое окисление имеет у детей, у которых механизмы антиоксидантной защиты (АОЗ) несовершенны и нестабильны, что определяет легкость их нарушения под влиянием различных неблагоприятных факторов (заболеваний, экологии и др.).
Главным источником АФК в клетках являются митохондрии, при нормальном функционировании которых 98 % поступившего кислорода используется для окисления жирных кислот с образованием АТФ (главного энергетического субстрата клеток) и 2 % – для синтеза АФК, который может значительно возрастать при различных патологических состояниях .
Установлено, что даже минимальная активность патологического процесса, функциональные нарушения сопровождаются изменениями в энергообразующих органеллах клеток шокового органа с развитием в них гипоксии и, соответственно, дефицита АТФ. Энергетический дефицит усугубляется резким усилением процесса ПОЛ, накоплением недоокисленных жирных кислот, электролитными сдвигами. Это касается прежде всего миокарда, почек, ЦНС и вегетативной нервной системы (ВНС), в клетках которых наиболее велики энергетические потребности.
Свободнорадикальная агрессия, изменения энергетики, метаболические сдвиги лежат в основе хронизации воспалительных заболеваний мочевой системы (хронического пиелонефрита – ХП и др.), являются одним из механизмов формирования вегетативной дистонии (ВД), особенно нейровегетативных кардиальных изменений.
Развитие большинства воспалительных заболеваний органов пищеварения также приводит к нарушению энергетического обеспечения клеток слизистой оболочки (СО) ЖКТ, а продукты ПОЛ, воздействуя на уровне субклеточных полиферментных систем, усиливают процесс запрограммированного апоптоза клеток с возможным повреждением носительницы генетической стабильности клетки – ДНК. Исследованиями А.И. Переслегиной установлено, что одним из повреждающих факторов в генезе развития хронических воспалительных заболеваний ЖКТ у детей является активация ПОЛ. Основным источником образования АФК в гастродуоденальной зоне являются полиморфноядерные лейкоциты, мигрирующие из крови и инфильтрирующие СО желудка и двенадцатиперстной кишки (ДПК). В условиях воспаления, гипоксии нарушаются механизмы регуляции по восстановлению кислорода, при этом большая часть его трансформируется в свободные радикалы, превращая процессы ПОЛ в неконтролируемые. Это приводит к истощению внутриклеточных ферментов, функциональным и структурным нарушениям цитомембран, клеточных органелл, прежде всего митохондрий, что создает энергодефицит как в СО гастродуоденальной зоны, так и в организме в целом. Существует мнение, что нарушения перекисного гомеостаза предопределяют рецидивирующий характер течения воспалительных заболеваний ЖКТ.
В настоящее время не вызывает сомнения защитная роль одного из клеточных субстратов – коэнзима Q10, обусловленная его участием в процессах энергетического обмена и антиоксидантным действием. Коэнзим Q10 осуществляет не только электронный транспорт в митохондриях, необходимый для синтеза АТФ, но и принимает непосредственное участие в сопряжении указанного процесса с окислительным фосфорилированием. Коэнзим Q10 занимает центральное место в АОЗ. Выполняя роль «мембранного клея», коэнзим Q10 сохраняет липидный слой мембран от разрушительных процессов ПОЛ, предохраняет ДНК и белки от окислительной модификации АФК. Особенностью коэнзима Q10 является его способность регенерировать (воспроизводиться) после окисления.
Для обоснования применения в педиатрической практике коэнзима Q10 проведена оценка его эффективности при патологии ЖКТ, мочевой и сердечно-сосудистой систем у детей и подростков.
В исследование были включены 90 детей и подростков в возрасте 5–15 лет, составивших 3 основные группы: 30 детей – с хроническим гастродуоденитом (ХГД), 30 детей – с ХП, 30 детей – с ВД. Критерием отбора пациентов в последнюю группу являлось нарушение процесса реполяризации в миокарде либо его сочетание с другими ЭКГ-изменениями. Сравнительные группы составили 60 пациентов (по 20 детей для каждого из исследуемых заболеваний). Пациенты основных и сравнительных групп были сопоставимы по характеру течения заболевания, полу и возрасту.
Обследование включало следующие параметры: анализ клинико-анамнестических данных; общеклинические и биохимические исследования. Для уточнения диагноза дети с патологией ЖКТ обследованы эндоскопически. У детей с патологией мочевой системы проводились лабораторные исследования для оценки функции почек, посевы мочи, рентгеноурологическое обследование (внутривенная урография, цитография), цистоскопия (по показаниям). Детям и подросткам с ВД исследовали состояние ВНС (тонус, реактивность, вегетативное обеспечение); проводили стандартную ЭКГ лежа, стоя, после физической нагрузки; суточное мониторирование АД (СМАД) и ЭКГ (ХМ ЭКГ); ультразвуковое исследование сердца (ЭХОКГ).
Изучали показатели ПОЛ и АОЗ: диеновые конъюгаты (ДК), малоновый диальдегид (МДА), общая антиоксидантная активность (АОА), активность антиоксидантных ферментов – супероксиддисмутазы (СОД), глутатионпероксидазы (ГТП), каталазы (КТ). Исследования показателей ПОЛ и АОЗ проводили в клинико-биохимической лаборатории НИИ им. Склифосовского (д.м.н. В.П. Давыдов). Уровень ДК в сыворотке крови определяли методом R.O. Recknagel, E.A. Glende; содержание МДА в сыворотке крови – методом В.Б. Гаврилова; определение АОА плазмы – методом Г.И. Клебанова и соавт.; активность СОД в эритроцитах – методом П.Г. Сторожук и соавт.; активность ГТП в эритроцитах – методом D.E. Paglia в модификации А.А. Маркина; активность КТ в эритроцитах – методом М.А. Королюк и соавт. При оценке нормы показателей ПОЛ и АОЗ использовали нормативы, разработанные авторами указанных выше методик. Статистическую обработку данных проводили на персональном компьютере с помощью пакета прикладных программ «Биостат». Результаты считали достоверными при р<0,05.
В зависимости от характера заболевания все обследуемые дети и подростки основных групп получали соответствующую терапию, в состав которой был включен водный раствор коэнзима Q10 (Кудесан). Группе детей и подростков с ВД, протекавшей с кардиальными изменениями, кардиотрофические препараты не назначались. В сравнительных группах терапия сочеталась с плацебо (дистиллированная вода). Лечебная доза Кудесана составляла 0,7–0,8 мг/кг (по убихинону). Продолжительность курса лечения – 3–4 недели. Исследование проводили на клинической базе кафедры педиатрии РМАПО в Тушинской детской городской больнице г. Москвы.
В процессе обследования детей с патологией ЖКТ выявлен ХГД в стадии обострения, который у 50 % обследуемых был поверхностным, у 46 % – гипертрофическим, у 4 % – эрозивным. При этом исследование состояния процессов ПОЛ и АОЗ выявило значительное повышение первичных (ДК) и вторичных (МДА) продуктов ПОЛ у большинства обследуемых (табл. 1).
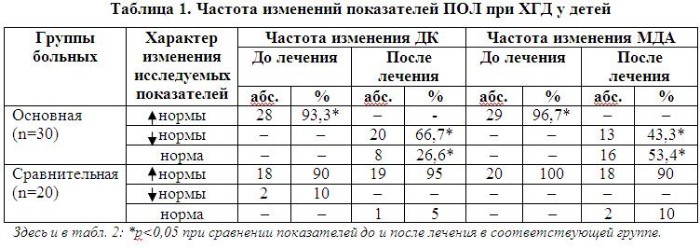
Содержание ДК и МДА в сыворотке крови у пациентов до начала терапии было значимо повышенным, составляя соответственно 1,4±0,08 Д233мл/мг и 2,47±0,1 нмоль/мг.
При определении антиоксидантных ферментов отмечено снижение активности СОД в обеих группах, только у 8 детей показатели оставались на уровне нормальных значений. Значительно чаще выявлялось снижение ГТП (табл. 2). При этом средняя активность СОД составляла 8,8±0,08 U/mgHb; ГТП – 0,31±0,04 U/mgHb (р<0,05 в сравнении с нормой: СОД – 12,5±0,3, ГТП – 0,39±0,02).
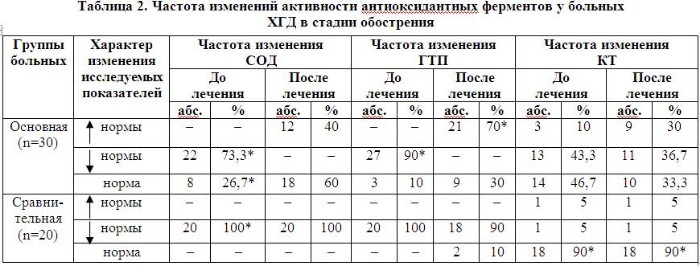
Частота снижения активности КТ была менее выраженной по сравнению с СОД и ГТП и наблюдалась лишь у 28 % пациентов обеих групп. Сказанное, вероятно, обусловлено высокой скоростью синтеза КТ при избытке продуктов ПОЛ либо слабой ответной реакцией КТ по устранению высокого уровня липидных пероксидов.
Эффективность терапии Кудесаном нашла отражение в положительной динамике показателей ПОЛ и АОА. Частота нарушений показателей ПОЛ и АОЗ до и после курса лечения приведена в табл. 1 и 2. Полученные данные свидетельствовали о том, что в основной группе по окончании курса лечения Кудесаном нивелирован дисбаланс в системе ПОЛ-АОА. Это выражалось в нормализации либо снижении ниже нормы содержания в крови ДК и МДА с одновременным повышением активности антиоксидантных ферментов (СОД и ГТП). В то же время динамика активности КТ была менее рельефной, обнаруживая лишь тенденцию к восстановлению активности. При этом средние величины активности ферментативного звена АОЗ в основной группе составляли: СОД – 12,8±0,2 U/mgHb (р<0,05 в сравнении с исходным результатом – 10,2±0,9), ГТП – 0,44±0,04 U/mgHb (р<0,05 в сравнении с исходной величиной 0,30±0,33), КТ – 12,6±2,1 U/mgHb (р>0,05 в сравнении с исходной величиной 11,2±2,0).

В сравнительной группе динамика частоты сдвигов содержания ДК, МДА в крови практически отсутствовала, лишь у 3 детей показатели нормализовались. Аналогичные результаты получены при оценке уровня ферментов. Средний уровень активности СОД и ГТП продолжал оставаться сниженным, обнаруживая лишь тенденцию к увеличению (соответственно 8,9±0,7 и 0,31±0,04 U/mgHb, р>0,05).
Выраженность клинической симптоматики у детей основной группы полностью исчезла на фоне терапии, а в сравнительной группе – уменьшилась. Это касалось ранних болей в эпигастральной области (сразу после еды), «тощаковых» болей, наблюдавшихся у 82 % обследуемых, диспептических расстройств (отрыжка, изжога, тошнота). В основной группе значительно повысилась физическая и умственная работоспособность (рис. 1).
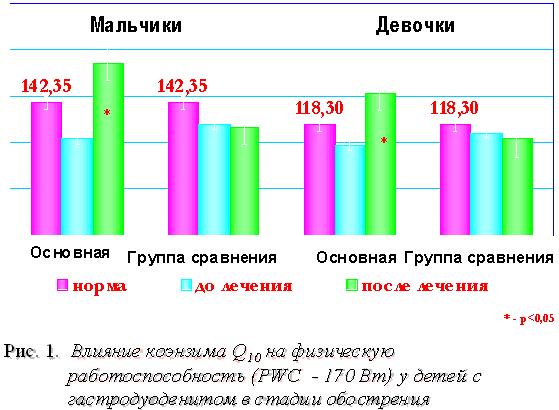
Таким образом, результаты исследований показали, что включение коэнзима Q10 (Кудесана) в состав комплексной терапии ХГД у детей и подростков позволяет существенно повысить эффективность терапии за счет нормализации процессов перекисного окисления, стабилизации цитомембран и восстановления клеточного энергообмена.
Обследование детей с ХП выявило его вторичный характер у 88 % пациентов. Процесс развился на фоне порока или аномалии развития мочевой системы, дисплазии почечной ткани, хронического цистита и обменных нарушений. Анализ клинико-лабораторных данных свидетельствовал о том, что у всех обследуемых пациентов наблюдалось обострение заболевания.
Включение Кудесана в состав комплексной патогенетической терапии (антибактериальной, иммунокоррегирующей, улучшающей микроциркуляцию) приводило к купированию активности процесса в более ранние сроки по сравнению со стандартной терапией. Так, на 2–3-й неделе курсового лечения в основной группе наблюдалось стихание активности процесса, в то время как в сравнительной группе выраженная активность сохранялась.
Исследование показателей ПОЛ и АОЗ выявило положительную динамику в основной группе в сопоставлении со сравнительной группой (табл. 3).
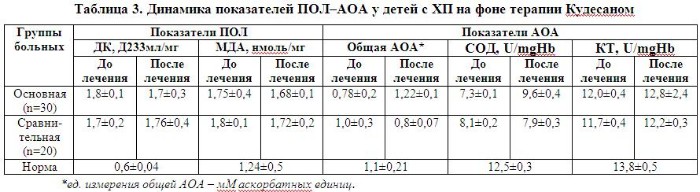
В основной группе отмечено достоверное повышение общей АОА до нормальных значений (р<0,05), увеличение активности СОД, однако нормализации показателя не наблюдалось (р>0,05). Наметилась тенденция к восстановлению активности КТ (р>0,05). Показатели ПОЛ (ДК, МДА) имели тенденцию к снижению концентрации в крови (р>0,05). Анализ результатов исследований в сравнительной группе существенной динамики не выявил, более того, наблюдалась тенденция к дальнейшему снижению АОЗ, в частности общей АОА и СОД.
При оценке влияния Кудесана на экскрецию с мочой отдельных метаболитов (оксалатов, мочевой кислоты, цистина) отмечено отчетливое снижение частоты обменных нарушений у больных ХП (рис. 2).
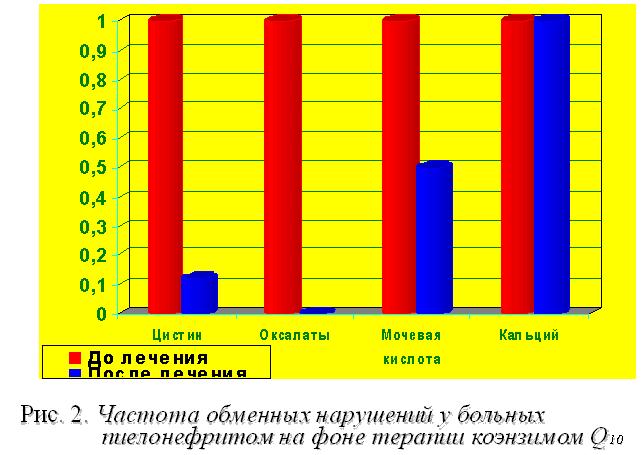
Выявленный факт свидетельствует о том, что антиоксидантная и энерготропная терапия коэнзимом Q10 (Кудесаном) способствует восстановлению нарушенных обменных процессов и достижению мембраностабилизирующего эффекта, помогает ликвидировать биоэнергетическую и функциональную недостаточность клеточных структур мочевой системы и организма в целом.
Исходя из изложенного, можно сделать вывод, что при ХП наблюдаются существенные нарушения в системе ПОЛ–АОА, выражающиеся в значительной интенсификации процесса ПОЛ и истощении АОЗ. Это наблюдается и при стихании активности процесса. Сказанное определяет необходимость проведения более продолжительных, а также повторных курсов лечения коэнзимом Q10 до полной ликвидации дисбаланса в системе ПОЛ–АОА.
При обследовании детей и подростков с ВД органическая патология сердца была исключена. У пациентов определены типы ВД, при этом симпатикотонический тип наблюдался у 32 %, ваготонический – у 28 %, смешанный – у 40 %. Исходно у пациентов с ВД отмечались множество жалоб астенического характера (у 44 из 50), а также кардиальных жалоб: сердцебиения (у 28 из 50), кардиалгии (у 19 из 50); ощущение нехватки воздуха при умеренной физической нагрузке (у 17 из 50); цефалгии (у 32 из 50); эпизоды головокружений (у 8 из 50); нарушения сна (у 21 из 50).
По данным стандартной ЭКГ нарушение процесса реполяризации в миокарде наблюдалось у всех обследуемых. Это выражалось в снижении высоты, изоэлектричности, направленности зубца Т в отведениях V4 – V6, смещении сегмента ST ниже изолинии не более 2 мм.
Проведение ХМ ЭКГ было наиболее информативным для выявления сочетаний ST–T-изменений с нарушениями ритма и проводимости. При этом были зафиксированы суточные колебания сердечного ритма от 46 до 160 уд/мин (у 28 из 50); синусовая тахикардия (у 14 из 50); синусовая аритмия (у 34 из 50); синусовая брадиаритмия (у 15 из 50); миграция водителя ритма (у 16 из 50); синоаурикулярная (СА) блокада II степени и атриовентрикулярная (АВ) блокада I степени в основном в ночные часы (у 8 из 50); суправентрикулярная экстрасистолия (у 6 из 50).
Эффективность терапии Кудесаном проявлялась в позитивной динамике как клинических, так и электрофизиологических данных. У детей основной группы динамика клинической картины была наиболее рельефной и выражалась в уменьшении частоты регистрации жалоб на головную боль (с 16 до 5 из 30), кардиалгии (с 11 до 1 из 30), сердцебиения (с 15 до 2 из 30), почти в 3 раза снизилось количество жалоб астенического характера (с 20 до 7 из 30). Можно полагать, что улучшение самочувствия, уменьшение жалоб привели к улучшению эмоционального фона и, соответственно, к уменьшению выраженности вегетативного дисбаланса.
В основной группе позитивная динамика ЭКГ-изменений характеризовалась нормализацией процесса реполяризации у 46,4 % пациентов, отчетливым улучшением – у 43 % и незначительным улучшением (только клиническим) – у 10,6 % пациентов. Усугубления ST–T-нарушений в ходе терапии не выявлено ни у одного обследуемого. В сравнительной группе нормализация ST–T-нарушений наблюдалась лишь у 15 %, отчетливое улучшение – у 35 %, только клинический эффект без динамики ЭКГ – у 50 % пациентов.
Из анализа результатов ХМ ЭКГ следовало, что в основной группе отмечалось заметное повышение представительности синусового ритма за счет уменьшения числа эпизодов миграции водителя ритма, СА-блокады и экстрасистолии. В то же время влияние на синусовую тахикардию было минимальным. В сравнительной группе уменьшилась выраженность миграции водителя ритма, другие показатели практически не изменялись (рис. 3 и 4).
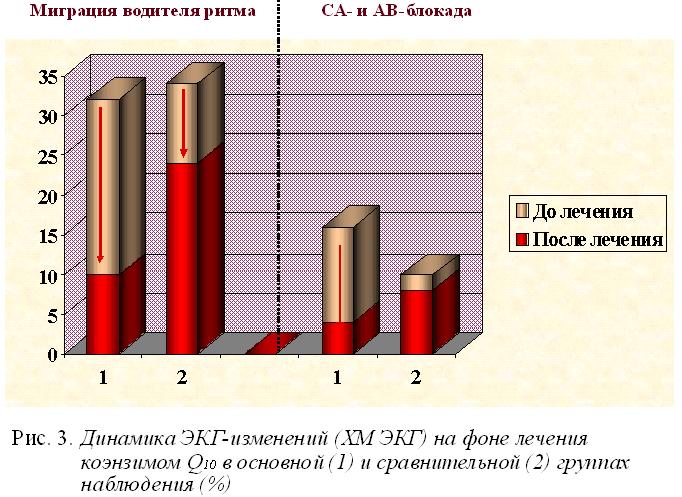
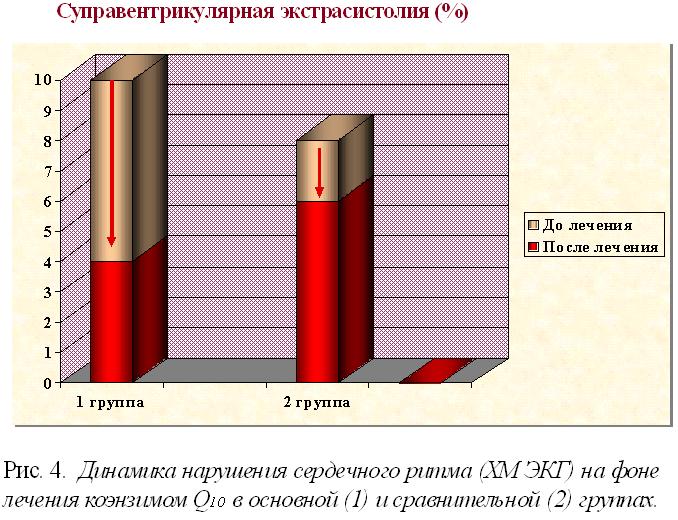
Из приведенных данных следует, что применение коэнзима Q10 эффективно не только при изменениях процесса реполяризации в миокарде, но и при нарушениях сердечного ритма и проводимости. Детальный количественный анализ результатов электрофизиологических исследований, оценка диастолической функции левого желудочка (по данным ЭХОКГ) на фоне терапии коэнзимом Q10 нами опубликованы ранее.
Таким образом, результаты собственных исследований и литературных данных свидетельствуют о том, что в большинстве случаев одним из механизмов развития патологического процесса и его хронизации является дисбаланс в системе перекисного каскада с ослаблением АОЗ и нарушением клеточной биоэнергетики. В педиатрической практике включение коэнзима Q10 в терапию позволяет ускорить выздоровление или достижение клинико-лабораторной ремиссии хронического процесса за счет стабилизации цитомембран и уменьшения их окислительного повреждения, а также дает возможность предупреждать развитие оксидантного стресса в органах-мишенях.
Повышение энергообмена на фоне терапии коэнзимом Q10 (Кудесаном) способствует улучшению функционального состояния миокарда, ВНС, почек, ЖКТ у детей и подростков. Сохраняющиеся изменения в системе ПОЛ–АОА при стихании активности хронического процесса позволяют назначать коэнзим Q10 более продолжительными (до 6 недель) и повторными курсами терапии. Это дает возможность не только полностью нивелировать выявленные сдвиги, но и, вероятно, предупредить последующие обострения.
И.Н. Захарова, Т.М. Творогова, Н.А. Коровина, Е.Г. Обыночная, К.М. Хрунова. Российская медицинская академия последипломного образования, Москва. Опубликована в издании «Педиатрия. Журнал имени Г.Н. Сперанского», 2011 г., т. 90, № 2.

Комментарии
Чтобы оставить комментарий: Войдите или Зарегистрируйтесь
