ОКИСЛЕНИЕ
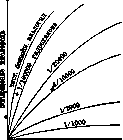
Рисунок 1.
2Н2 + С (аморфн.) + С (аморфн.) S + 2Р + Mg + Соответственно хотя это действие повидимому не бесконечно долгое время. Экспериментально показано, что автооксидация тесно связана с полимеризацией и конденсацией (осмоление). Катализаторы у них общие. Реакции автооксидации сопровождаются свечением и светочувствительны. Определения, произведенные Бекстремом (Backstrom) для автооксидации бензойного альдегида, дали длину цепи (см. ниже) в десятки тысяч молекул для первого стадия (А+02) и значительно более короткие во втором (А[02]+А). Роль замедлителей О. сводится к обрыву цепей в первом стадии. Т. к. цепи очень длинны, то для этого достаточно прибавления очень малого количества отрицат. катализатора. Горение происходит при быстром О., сопровождаемом пламенем. Многие вещества, окисляясь, выделяют очень много тепла, например: Оа=2Н30 + 136 000 кал. 0,=СОг + 97 000 » Vs02=CO + 29 000 » Oa=S03 + 77 300 » 502=Р206 + 370 000 » 02=MgO + 143 900 » этому t° пламени достигает весьма больших величин: водорода— 2 320°; СО—2 430°; СН4—2 150°; паяльная горелка на смеси Н2 и 02 дает 3 000° и т. д. В этих случаях скорость реакции горения зависит помимо длины цепей (см. ниже) и от разогревания всей массы горящего газа.Суще-ствует и так наз. холодное пламя, при низких давлениях, при разбавлении индифе-рентным газом. Общая t° горящей смеси при этом очень мала, но энергия отдельных молекул конечно остается очень высокой. Здесь скорость реакции зависит исключительно от распространения цепей. Теория горения. Согласно кинетической теории (см.) скорости и энергии молекул при данной абсолютной температуре Т неодинаковы и распределены по закону Максвела-Больцмана. Хотя большая часть молекул имеет энергию порядка RT (R = = 1,98 кал.), но имеется малая дробь { от общего числа молекул с очень большим избытком энергии. В реакцию вступают сталкивающиеся между собой молекулы реагирующих веществ, но не все, а лишь обладающие избыточной энергией (энергия активации, около 30 000 кал.). Т. о., чтобы молекулы прореагировали, необходимо пре- 215 ' ОКИСЛЕНИЕ 216 дварительно подвести энергию. Так, чтобы уголь загорелся, его нужно нагреть. Выделяющаяся при реакции теплота, нагревая смесь, сможет снова доставить энергию активации. Т. к. с повышением температуры чис- е ло активных молекул I очень быстро возрастает, то скорость реакции также быстро возрастает, обычно при нагревании на 10° в 2 раза. При повышении t° О. от 200° до 2 200° скорость реакции увеличивается в 10й раз.—Реакции горения суть цепные реакции. Каждый первичный акт реакции молекулы с кислородом является началом энергетической цепочки: образовавшаяся молекула в первый момент своего появления несет очень большую энергию; столкнувшись с молекулой исходного вещества, она передает ей свою энергию, эта вторая молекула становится активной, реагирует, процесс повторяется далее и идет цепью. Т. о. число активных молекул значительно увеличивается сравнительно с первоначальным. Константа скорости реакции (число реагирующих в единицу времени молекул при давлении, равном единице) W=n-{-aW, где п—число первоначально активных молекул и а—вероятность активирования молекулы, столкнувшейся с прореагировавшей. Отсюда W = ^; j^ есть длина цепи, т. е. число вторичных актов реакции, вызываемых первичными. Длина цепей достигает величин порядка 104—10е. Если в своем продвижении такая цепь встретит молекулы, которые, поглощая энергию, не реагируют дальше, напр. молекулы постороннего вещества (стенки сосуда), то цепь обрьюается. Т. о. скорость горения зависит от диаметра сосуда. В капилярах (<3,5 мм) горение не идет, так как цепи слишком быстро обрываются и газ не успевает разогреваться. На этом основано действие предохранительной лампы Деви для углекопов, применение водяных бань с предохранительными металлическими сетками в лаборатории и т. д. Температура воспламенения. При низких t° скорость реакции мала, и выделяемое тепло уводится стенками сосуда (медленное О.). С повышением t° скорость реакции увеличивается быстро (пропорцио- е нально I ), отвод тепла—медленно (про- порционально t°). При темп., когда тепло-приход уже не компенсируется теплоотво-дом, получается лавинообразное увеличение скорости и как следствие—взрыв, горение. Это и есть t° воспламенения. Температуры воспламенения в смесях с воздухом при атмосферном давлении: СО, СН4—650°, Н2—5 50°, С2Н2—450°, CSa—350°, РН3—100°. Зависимость от дав л ения. Когда скорость горения зависит от разогревания всей массы газа (см. выше), t° воспламенения зависит от давления. Скорость реакции по закону действия масс пропорциональна давлениям реагирующих газов и кислорода, а теплоприход пропорционален скорости реакции. Пусть давление и скорость реакции малы и теплоприход Q в зависимости от t° выражается кривой 3, а теплоотвод—наклонной прямой (рис. 2). Если реакция О. началась при tp T0, то теплоприход больше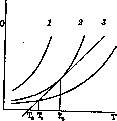
Рисунок 2.
теплоотвода и смесь разогревается до ТХг где эти величины сравняются. Дальше разогревание не произойдет, т. к. теплоприход, уже меньше возможного теплоотвода (прямая выше кривой 3). Т. о. взрыва нет. При большем давлении достигается условие (кривая 2), что прямая касается кривой в точке Т2, выше нее тепло-отвод остается меньше теплоприхода, а скорость реакции чрезвычайно быстро увеличивается—пр оисходит взрыв. Если давление еще выше (кривая 1), теплоотдача всегда меньше теплоприхода _ и быстро наступает взрыв. Т. о. существует низший предел воспламеняемости, зависящий от давления. Из этих критических давлений можно вычислить энергию активации (Семенов). Понижение t° воспламенения при сжатии, т. е. воспламенение сжатием, использовано в моторе Дизеля. Впрыскивая бензин в воздух, сжатый до 50 атмосфер, вызывают его моментальное воспламенение; t° газа повышается при этом до 1 000°. Т. н. антидетонаторы (тетраэтил-свинец и др.) повышают t° воспламенения, обрывая цепи, и позволяют использовать более высокие давления. Существуют пределы воспламенения в зависимости от состава смеси. Горение в смесях с воздухом происходит лишь при содержании: На—от 10% до 70% Н„ СО—от 16% до 75% СО, светильн. газа—от 8% до 25% газа. Когда одного компонента слишком много, горение не может распространяться, так как выделяющаяся при реакции между молекулами энергия растрачивается без распространения цепей. Аналогичное разбавляющее действие производит прибавление негорючего газа. Интересно далее существование верхнего предела давления для горения смесей, выше которого они не загораются. Распространение горения.. Если поджечь с одной стороны горючую смесь, заключенную в горизонтальную длинную (несколько метров) трубку, то распространение горения—вначале небыстрое, равномерное— быстро ускоряется, производя колебания, часто звук. Конечной фазой, встречающейся, правда, не всегда, является т. н. взрывная волна, т. е. волна сжатого-(до 50 атм.) газа очень высокой t°. Скорость ее распространения очень постоянна и соизмерима с молекулярными скоростями, откуда можно вычислить последние. Объемный состав смеси Скорость взрывной волны (метры в секунду) СаН2 + Оа СН4 + Оа 3 530 1 710 2 900 2 528 1 Замечательно, что сухие смеси с кислородом (СО, паров серы, Р, С) не горят (содержание воды < 0,0001%). О. атомарным кисл ор од ом. При пропускании кислорода через разрядные* трубки (3 000 V, 250 тА) при давлениях около 1 мм можно получить газ, содержащий до 30% атомарного кислорода (совершенно аналогично получению атомарного, «активного» водорода). При диссоциации молекулы кислорода поглощается 126000 кал.; ясно, что атомы обладают большим запасом энергии. Поэтому, встречаясь с парами большинства органических веществ, они производят очень энергичное окислительное действие, сопровождающееся свечением. Контакты о-к аталитическоеО. Твердые поверхности могут не только препятствовать О. (см. выше), но и ускорять его. Последнее, каталитическое действие в значительной степени зависит от хим. природы поверхности. Механизм этого действия может быть различен. 1) На стенках могут появляться центры, откуда начинаются новые цепи, например вследствие того, что энергии адсорпции или хим. действия стенки бывает достаточно, чтобы расщепить молекулу и выслать образовавшиеся группы или свободные атомы в объем, где они и начинают цепочки. Таков по Габеру (Haber) механизм катализа гремучей смеси кварцем, высылающим в объем группы ОН, всегда имеющиеся на его поверхности. Такой механизм окислительных реакций особенно вероятен вследствие большой их экзотер-мичности. 2) Другой механизм признает Ленгмюир (Langmuir) для соединения с кислородом молекул СО и Н2 на поверхности платины. Кислород, адсорбированный платиной, распадается на атомы, остающиеся на поверхности. Реакция происходит при каждом ударе молекулы СО или На из газовой фазы с поверхностными атомами О. Образовавшиеся молекулы С02 или Н20 быстро улетают, возобновляя свободное место для следующего подобного цикла. Эти свободные места могут заниматься непроизводительно молекулами СО или Н2 или молекулами. продуктов реакции, и тогда происходит уменьшение действующей поверхности. Процессы каталитического окисления получили громадное применение на практике—поверхностное сжигание топлива, контактный способ получения серной кислоты, О. аммиака в азотную кислоту, процесс Дикона, конверсия метана, получение ацет-альдегида из спирта, фталевого ангидрида из нафталина, бензойной кислоты из толуола, антрахинона из антрацена и т. д. Катализаторами служат Pt, Cu, V205,Mo03, W03, активированный уголь и другие вещества, обычно обладающие несколькими степенями О. При окислении органических веществ первичным процессом обычно является дегидрогенизация, а выделяющийся при этом водород окисляется кислородом до воды. Например: сн3.сн2он -». сн3сон+н2 Си 2На+02 -»■ Н20. Что дегидрогенизация является первым стадием процесса О., постулируется также Виландом (Wieland). Существенна при этом роль воды. Так, окисление S02 в S03 по Виланду происходит по схеме: S02 + H20=H2S03; H2S03=S03+H2; 2Н2 + 02=2Н20. Самовозгорание. Уголь, зерно, сено, масляные тряпки от обтирки машин и т. д., хранящиеся долго в больших кучах, часто сами собой загораются. Эти пожары происходят оттого, что теплота, развивающаяся вследствие медленного О., постепенно накопляется, т. к. внутренние слои хорошо теплоизолированы. От этого постепенно увеличивается скорость реакции, могущая привести к воспламенению. Мелкораздробленные Fe, Ni и др. (например Ni, восстановленный водородом из окиси при 300°) сами загораются на воздухе (пирофориче-ские металлы). Объясняется это особой активностью поверхности, где в этих условиях многие атомы приближаются по своим свойствам к активным атомам. Окисление быстро распространяется, т. к. мелкие частицы металла плохо отводят тепло, к-рое остается тут же, накопляясь. Относительно процессов окисления в организме—см. Окислительные ферменты, Обмен веществ, обмен энергии, Мышцы. Лит.: Труды III Физ.-хим. конференции, Л., 1930 (работы Н.Н. Семенова и Г. Баха); Шило вН., Сопряженные реакции окисления, Ж., 1905; Н о и-b e n J., Methoden der organischen Chemie, Lpz., В. II, p. 3—-222,|Lpz., 1925. А. Баландин. Смотрите также:
Смотрите также:
- ОКИСЛИТЕЛЬНЫЕ ПРОЦЕССЫ, химич. реакции взаимодействия с окислителями. Очень распространены в природе и имеют большое практич. значение (см. Окисление).
- ОКИСЛИТЕЛЬНЫЕ ФЕРМЕНТЫ, группа ферментов, обусловливающих окислительные процессы, идущие в растительных и животных клетках как при их жизни, так и первое время после разрушения протоплазмы. Наиболее важным с биол.точки зрения О. процессом ...
- ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности ...
- OCCLUSIO FOETALIS, s. inclusio foetalis (лат.), букв, обозначает врожденное включение. Термин относится к той разновидности двойных уродств, когда какие-либо части недоразвитого плода-близнеца помещаются внутри полости тела другого плода, развивавшегося правильно. Происхождение ...
- ОКОЛОПЛОДНЫЕ ВОДЫ (амниотические воды), жидкость, находящаяся в околоплодном мешке (амниотическом). О. в. встречаются только у высших позвоночных животных (рептилий, птиц, млекопитающих и человека), известных под названием Amnio-ta в отличие от другой группы ...