ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ, периодический закон. Уже с давних пор были делаемы попытки установить зависимость свойств элементов от их атомного веса: Деберейнер (Dobereiner, 1817) указал на триад ы подобных элементов, между атомными весами к-рых наблюдаются почти одинаковые разности (напр. Са=40,1, Sr=87,6, Ва=137,4), далее де Шанкуртуа и Ньюландс (de Chancourtois, A. R. Newiands; 1862) указали на «закон октав» и др., но только Д. И. Менделеев в 1869 г. наиболее полно выяснил связь между отдельными группами элементов. Вскоре, в 1870 г., Л отар Мейер (Lo-thar Meyer) независимо от Менделеева в статье «О природе химических элементов как функции их атомного веса» высказал взгляды, сходные со взглядами Менделеева. Основной принцип системы Менделеева можно формулировать след. образом: химические и физические свойства соединений, образуемых элементами, находятся в периодической зависимости от величины атомного веса. Менделеев расположил элементы по порядку величины их ат. весов, причем обнаружилось, что существует как бы период свойств соединений элементов и по атомности элементы каждый восьмой элемент повторяет свойства элемента, принятого первым при счете: Na сходен по свойствам своих соединений с Li,' Mg—с Be, Si—с С, С1—с F. Т. о., если все элементы расположить в порядке возрастания их атомных весов, то наблюдается ясная периодичность свойств их соединений, поэтому Менделеев предложил назвать такую систему расположения элементов периодической. Открытый им закон периодичности он формулировал так: свойства простых тел, также форма и свойства соединений элементов, находятся в периодической зависимости, или, выражаясь алгебраически, образуют периодическую функцию от величины их атомного веса. Такое периодическое появление сходных элементов могло быть яснее обнаружено при размещении всех элементов в таблицу, к-рую Менделеев поместил в первом издании своих «Основ химии», а затем и в последующих изданиях (кончая восьмым в 1905 г.), несколько изменяя форму таблицы, хотя в основном она оставалась неизменной. До открытия т. н. «благородных газов» (аргона, гелия, неона и др.) таблицы заключали 8 вертикальных рядов (групп), означенных римскими цифрами, и 12—горизонтальных. Группы заключают в себе сходные элементы, образующие естественные семейства; в каждой группе находятся элементы, относящиеся к четным и нечетным рядам. После открытия в 1894—95 г. аргона и его аналогов была добавлена особая «нулевая группа» (табл. 1 и 2) следуют друг за другом в порядке арифметической последовательности их ат. весов. Если, начиная с легчайшего металла—лития, расположить Li = 6,94; Ве = 9,02; В = 10,82; С= = 12,00; N = 14.01; 0 = 16; F = 19,00;Na = 23,00; Mg=24.32; Al = 26,97; Si = 28,06; P = 31,02; S = 32,06; С1 = 35,46, то оказывается, что свойства элементов изменяются постепенно: от типического металла лития через В, С, N переходим к наиболее типическому металлоиду фтору. То же наблюдается и во втором ряду: VІII). В первом ряду Менделеев поместил один воДород; во втором ряду находятся Не, Li, Be, В, С, N, О, F; третий ряд начинается с неона (Ne) в нулевой группе, за ним следует Na, Mg и т. д. Так. обр. скачок от галоидов (F, C1) к металлам I группы, к-рый наблюдался с 1871 года, установлением нулевой группы сгладился: фтор—элемент с резко выраженными электроотрицательными свойствами, натрий—с таковыми же электроположительными; переход от первого ко второму про- исходит через неон—элемент совершенно нейтральный, в к-ром оба противоположные электричества как бы совершенно уравновесились. То же самое можно сказать про переход от хлора к калию через аргон, от брома через криптон к рубидию, от иода к цезию через ксенон. Вообще переход элементов нечетных рядов: 3-го, 5-го и 7-го к элементам четных рядов 4-го, 6-го, 8-го совершается через элементы нулевой группы (объяснение с точки зрения электронной теории строения атомов см. ниже). Переход же от четных рядов (4-го, 6-го, 10-го) к нечетным (5-му, 7-му и 11-му) совершается через VІII группу, содержащую в каждом ряду по 3 элемента: в 4-м Fe, Co, Ni, в 6-м Ru, Rh, Pd и в 10-м Os, lr, Pt. Начиная с 4-го ряда наблюдаются большие периоды, состоящие из двух малых; таких периодов 3: первый состоит из 4-го и 5-го рядов, второй—из 6-го и 7-го, третий из 10-го и 11-го рядов. Эта двойная периодичность проявляется в том, что элементы четных рядов в каждой группе, напр. Li, К, Rb, Cs или Ca, Sr,Ba, обнаруживают большее сходство между собой, чем элементы четного ряда и следующие за ним нечетного ряда (напр. К и Си, Са и Zn). To же можно сказать про элементы нечетных рядов: например Р, As, Sb в V группе, Cl, Br, J в VІI и т. д. Вообще можно заметить, что элементы нечетных рядов обладают нек-рыми общими свойствами, напр. элементы, принадлежащие к нечетным рядам IV, V, VІ и VІI групп способны образовать газообразные водородистые соединения, металлоорганические и т. п.; они б. ч. диамагнитны, элементы же четных рядов—парамагнитны и т. д. Рассмотрение таблицы элементов приводит к следующим выводам: 1. Одним из основных свойств элемента, определяющим место его в периодической системе, является его атомность (валентность)—способность его атома соединяться только с определенным числом других элементов, причем наиболее характерными являются валентности элементов по кислороду и по водороду (или галоиду). Состав. высших солеобразующих кислородных соединений определяется номером группы: элементы первой группы образуют окислы общей формулы R
20, второй-—RO (R
20
2), третьей R
20
3 и т. д. до R
20
8 (R0
4). Номер группы указывает число атомов кислорода, соединяющихся с двумя атомами элемента, другими словами— атомность (или валентность) элемента по отношению к кислороду. К первой группе относятся элементы одновалентные, ко второй—двухвалентные, к третьей—трехвалентные..., к седьмой—семивалентные. Начиная с IV группы и кончая VІI элементы С, N, О, F и элементы нечетных рядов образуют водородистые газообразные соединения, в которых проявляют атомность (или валентность) к водороду иную, чем к кислороду, причем сумма единиц валентностей по отношению-к кислороду (А) и водороду (R) равна 8 (A+R = 8). Т. о. для этих элементов нужно-различать валентность по отношению к кислороду (электроположительную) и по отношению к водороду (электроотрицательную), причем первая возрастает вместе с номером группы (с 1 до 8), вторая же, наиболее резко проявляясь у элементов IV, V, VІ и VІI групп, падает при переходе от элементов IV группы вышеуказанным образом. Зная, к какой группе элемент принадлежит, можно прямо сказать, какова его валентность по отношению-как к кислороду, так и к водороду. 2. Элементы 2-го ряда (Li, Be, В, С, N, О,. F), названные Менделеевым типическими, обладают наименьшими атомными весами и являются наиболее распространенными в верхних слоях литосферы и атмосферы. 3. Что касается положения металлов и металлоидов, то можно указать три направления, по к-рым~ совершается постепенное и правильное изменение металлического электроположительного характера в металлоидный электроотрицательный. А. Первое направление было указано в самом начале, а именно—в первых горизонтальных рядах от элементов I группы к VІI мы наблюдаем переход от металлов к металлоидам. Б. В одной и той же группе при движении сверху вниз замечается повышение-металлических свойств элементов, а следовательно и возрастание основных свойств их~ окислов по мере увеличения ат. веса: это наблюдается для элементов как первых (I и II групп) (напр. К, Rb, Cs и Ca, Sr, Ba), так в особенности IV—VІI (напр. С, Si, Sn, Pb или N, P, As, Sb, Bi), и даже в VІI группе у иода (галоида с наибольшим ат. весом) наблюдается
-проявление металлических свойств: в одно-хлористом иоде (JC1) и треххлористом иоде-(JC1
3) иод по отношению к хлору ведет себя* как металл. Из вышесказанного следует, что наиболее электроотрицательный элемент должен занимать правое верхнее место (оно и занято фтором), а наиболее электроположительный металл (цезий)—левое нижнее место. Т.о. «каждый элемент в периодической системе имеет место, определяемое группой и рядом, в к-рых он находится. Группа и ряд указывают величину ат. веса, свойства и форму высшего окисла, водородного и других соединений—одним словом главные количественные и качественные признаки элемента». Если в нек-рой группе находятся элементы: R
1; R
2, R
3, а в том ряду, где содержится один из этих элементов, например R
2, находится перед ним элемент Q, а после него элемент Т, то свойства R.. определяются по свойствам R
x R
B, Q и f. Так, ат. вес R
2 = V4(Ri+R
3+ + Q + T). Напр. ат. вес селена, находящегося между серой (S=32), теллуром (Те = 127,5), мышьяком (As = 74,96) и бромом (Вг=79,92), равен V*(32 + 127,5 + 74,96 + 79,92) = 78,58, т. е. близок к найденному 79,2. Также можно определить и другие свойства селена и его соединений, если бы они не были известны. Менделеев при самом установлении П. с. э. указал, что она может служить для предсказания свойств в неизвестных еще элементах. При расположении элементов в порядке возрастания атомных весов Менделеев столкнулся с тем фактом, что между атомными весами кальция и титана наблюдается прорыв в восемь единиц, Zn и As—в десять единиц, но это обстоятельство не смутило Менделеева, и он поместил титан в IV группу, а мышьяк—в V, свободные же места заполнил тремя неизвестными элементами, которым он дал названия: экабор, экаалюминий (Еа = 68—-70) и экасилиций (экакремний) (Es=72). Вскоре же предсказания свойств новых элементов получили подтверждение. В 1875 году Лекок де Буабодран (Lecoq de Boisbaudran) открыл в цинковой обманке элемент, названный им галлием, подходящий по свойствам, предсказанным для экаалюминия; в 1880 году Нильсон (Nilson) открывает скандий и указывает, что не остается никакого сомнения, что в скандии открыт экабор, а в 1885 году Винклер (Winkler) нашел германий, свойства соединений которого вполне совпадают с предсказанными для экасилиция. В своей статье Винклер пишет: «Вряд ли может существовать более ясное доказательство справедливости учения о периодичности свойств, чем оплодотворение до сих пор гипотетического «экасилиция»; оно составляет конечно более, чем простое подтверждение смелой гипотезы, оно знаменует собой выдающееся расширение химического поля зрения, гигантский шаг в области познания». Менделеев не только предсказал свойства новых элементов, но, руководясь П. с э., предложил изменить ат. вес нек-рых элементов; индия (In = 114,8) и урана, для к-рого он предложил удвоить прежний ат. вес, т. е. принять U = 239, вместо 119. Порядковые числа. Изотопы. Плеяды. Благодаря успехам физики и химии в конце 19 и начале 20 вв. произошел резкий переворот во взглядах на строение материи и на атом. Согласно классической теории атомы тел являлись основными, неразрушимыми, как бы киргичами мироздания, к-рые никакими силами не могут быть разрушены или видоизменены. Так смотрели на атом такие ученые, как Максвелл (Maxwell), Менделеев и многие другие. Такой взгляд основывался на том факте, что в действительности при химич. реакциях атомы являются химич. индивидуумами. Менделеев до конца жизни отстаивал такую точку зрения, а идею об единой материи, входящей в состав всех атомов, характеризовал как утопию. В наст. время сложность строения атомов подтверждена многими опытами, и предложено несколько моделей строения атомов из протонов и электронов, но несмотря на это П. с. э. получила только подтверждение, т.к. согласно новым теориям места элементов в П. с. э., указанные Менделеевым, должны быть сохранены.-—Основное положение теории Бора [затем разработанной Косеелем (Kossel) и другими] заключается в том, что атомы каждого элемента представляют сложную систему, состоящую из положительно заряженного ядра, вокруг которого вращаются электроны, орбиты к-рых.расположены в несколько слоев. Число всех электронов, окружающих ядро. равно его положительному заряду. Это следует из того, что атомы элементов в свободном состоянии электрически нейтральны. Как показал Мозли (Moseley, 1911), величина положительного заряда, определенная на основании спектров рентген, лучей, или иными словами число планетарных электронов равно атомному номеру или порядковому числу, указывающему порядок расположения элементов в П. с. э. В 1920 г. Резерфордом и Чедвиком (Rutherford, Chadwick) прямым опытом было определено, что заряды положительного ядра атомов меди, серебра и платины равны+29,3
е, +46,3
е и +77,4
е. Атомные же порядковые числа, определенные из рентген, спектров, равны 29, 47 и 78. Отсюда видно, какое важное значение имеют опытные определения величины положительного заряда ядра. Порядковые числа элементов на основании метода Мозли были определены для всех элементов, начиная с водорода и кончая ураном (92). Для первых 20 элементов, до кальция включительно, порядковые числа близки к половине ат. веса (табл. 3). Расположение элементов на основании порядковых чисел подтвердило правильность прежнего порядка элементов, указанного Менделеевым, и закрепило место за иодом (J=126,9) после теллура (Те = 127,5), за никелем (Ni = 58,96) позади кобальта (Со = = 58,97) и за аргоном (Аг=39,88) перед калием (К=39,10). Эти отступления получили простое объяснение в новой формулировке П. с. э.: П. с. п р е д с т а в л я е т классификацию, основанную на числе планетарных (т. е. окружающих атомное ядро) электронов; свойства элемент о в—п ериодическая функция их атомных порядковых чисел, а не атомных весов. Определение порядковых чисел элементов позволило узнать, сколько и какие элементы еще не открыты. Т. о. определены места металлов редких земель (с 59 по 72) (табл.3). . Было найдено, что отсутствуют оба гомолога марганца — мазурий (с порядковым числом 43) и рений (Re = 186,31, порядковое число = 75), гомолог.иода (порядковое число 85) и цезия (порядковое число 87). Из них рений найден и довольно хорошо исследован; что касается до мазурия, то указания относи- Табл. 3.. Периодическая система элементов. i а аз £ н И о к Группа
~1 Группа VІII Группа I a b Группа II Груп.Ill a b I a b Груп. IV | Груп. V
' Груп. VІ ' Груп. VІI a b a ba b | a b ! I 4 5 6 7 8 9 10 2 Не 4,002 ! 3 Li a Be 6,940 9,02 5 В 10,82 13 Al i6,97 6 С | 7 N 12,000 | 14.008
________________________!.....__ 14 Si j 15 Р 28,06 'i 31,02 I 8 0l 9 F 16,00 ! 19.00
! 10 Ne 20,18 18 АГ 39,94 11 Na 22,997 19 К 39,104 29 Cu 63,57 12 Mg 21,32 16 S I 17 Cl 32,06 ] 35,457
i 20 С а 40,07 21 Sc 45,10 1 22 Ti !23 V 24 Cr 47,90 !50,95 52,01 25 Mil 51,93 26 Ре 27 Со 28' N1 55,84 58,94 58,69 30 Zn 65,38 31 Ga 69,72 32 Ge 72,60 33 AS | 34 Se 74,93 79,2 35 Br 79,916 36 Кг 82,9 £7 Rb 85,45 38 Sr 87,63 39 Y 88,93 40 Zr 91,22 41 Nb 42 Mo 93,5 J96.0
! 43 Ma 41 Ru 45 Rh 46 Pd 101,7 102,9 1(6,7 47 Ag 107,880 48 Cd 112,41 49 In 114,8 50 Sn 118,70 1
51 Sb; 52 Те 121,76J 127,5 53 J 126,£3 54 X 130,2 55 Cs 132,81 56 В а 137,36 57 La 138.90 53 Cl |59 Pr 60 Nd 61 11—62 Sm 63 bu 110,13110,92 144, L7 15):43 152,0 64 Gd 157,3 65 Tb 66 Dv 67 Ho 68 Er 69 Tu 70 Yb 159,2 162,46 163,5 167,64 169,4 173,5 71 Zu 72 Hf]73 Та 175,0 178,6 181,36 74 \V 75 Re 186,61 86 Em (222,0) 76 Os 77 Ir 78 Pt 190,9 193,1 125,23 1 79 AU|80 Hg 197,2 |200,6i 81 Tl 204.39 1 S2 Pb |83Bi 207,21 ! 209,00 i 84 Po (210,01) 85— " VІ 88 Ra 225,97 89 AC (227) I 90 Til ] 91 Pa 232,12 (231) 92 U 238,14 Рядом с символами элементов указаны порядковые номера, под ними атомные веса. Между таллием (81) и ураном (92) почти каждое место системы занимают несколько, большей частью радиоактивных элементов. В таблице даны символы и атомные веса только наиболее устойчивых (распространенных) элементов каждой плеяды. Нек-рые обыкновенные элементы являются смесями нескольких изотопов. тельно его нельзя считать прочно установленными. Открытие
изотопов (см.) внесло новое изменение в понятие ат. веса. Так как место, занимаемое атомом в П. с. э., определяется величиной положительного заряда атомного ядра, то атомы различного веса, но с одинаковым зарядом ядра, попадут в одно и то же место и, обладая одинаковыми хим. свойствами, не могут быть отделены друг от друга. Определенный при таких условиях ат. вес представляет некоторое среднее значение для различных атомов, занимающих одно и то же место в П. с. э., для т. н. изотопов. Группа из нескольких изотопов образует плеяду, как ее назвал Фаянс (Fajans). Различие между ат. весами изотопов может доходить до 4 и более единиц. Объяснение П. с. э. с точки зрения электронной теории строения атомов. Из двух главных составных частей атома каждого химич. элемента—ядра и его планетарных электронов—на свойства элемента непосредственно влияют только число внешних электронов и их расположение на орбитах, ядро же влияет лишь постольку, поскольку его электрический заряд определяет число планетарных электронов и их распределение по отдельным орбитам. Число электронов в самом внешнем слое подвержено значительным колебаниям: от одного до восьми. Атом водорода имеет один электрон, атом гелия—2, они образуют первую сферу (или первое кольцо). С лития начинается второй слой, в к-ром у лития находится один электрон, у бериллия—2, у бора—3, у углерода—4, у азота—5, у кислорода—6, у фтора—7, у неона—8 электронов. Затем идет третий слой, в к-ром число электронов возрастает опять от одного у натрия до 8 у аргона. Затем идет 4-й слой, в к-ром наблюдается то же возрастание от 1 у калия до 7 электронов у марганца. Каждый период начинается всегда элементом с одним внешним электроном и заканчивается элементом с восемью внешними электронами; затем при последовательном порядке образования элементов эти восемь электронов становятся внутренними и появляется снова один внешний электрон, характеризующий собой атом первого элемента следующего нового периода—очередного щелочного металла. Существует большое различие в свойствах атома, к-рые зависят от наружного и от внутренних рядов электронов. В то время как свойства атома, зависящие от внутренних рядов электронов, изменяются последовательно от элемента к элементу, как это показано Мозли для чисел колебаний рентген, лучей, свойства элементарных атомов, зависящие от внешнего слоя электронов (прежде всего химич. свойства), изменяются периодически. Электроны внешнего слоя (или валентные) наиболее легко отделяются, и число их определяет число единиц положительной валент-
42 i ности (атомности) атома; так, оно равно 0 в атоме гелия, 1—у одновалентного атома лития, 2—у двухатомного бериллия и т. д. Число внешних электронов в атомах неона и аргона равно 8; ни аргон ни неон не вступают в хим. соединения, т. е. они не проявляют никакой положительной валентности, следовательно ни один из их внешних электронов не может быть отделен ни при каком хим. процессе, а это указывает на то, что слой из 8 электронов очень устойчив. Т. о. сочетание из 8 электронов, образующих внешний слой атома в газах 0-группы, обладает наивысшей устойчивостью. Слой же в один электрон является наименее устойчивым, и из него легко отделяется один электрон (т. е. образуется катион); несколько устойчивее слой из 2 электронов и т. д.; слой из 7 электронов стремится прибавить к себе 1 электрон для образования устойчивого сочетания из 8 электронов; слой из 6 электронов стремится прибавить к себе 2 электрона, но с меньшей силой и т. д. Основываясь на таком представлении о строении атомов, Коссель очень просто объясняет многие хим. явления и в частности комплексные хим. соединения. Образование соединений можно объяснить, рассматривая чисто электростатические силы. Так напр. процесс образования хлористого натрия (NaCl) объясняется следующим образом: сперва электрон из внешнего слоя атома натрия отрывается от атома и присоединяется к внешнему слою из 7 электронов атома хлора. Т. о. получается 2 иона: Na
+ и СГ; оба они имеют устойчивые внешние слои из 8 электронов. Ионы, несущие противоположные заряды, притягиваются друг к другу и образуют молекулу NaCl. Валентность элемента по отношению к кислороду определяется числом электронов, находящихся в наружной обо-,лочке: так, натрий имеет в наружной оболочке 1 электрон, Mg—2,
Al—3, Si—4, Р—5, S—6, Cl—7. Затем следует аргон с 8 электронами в наружной оболочке и валентность элемента падает до 0. Подобная же картина наблюдается далее: за 7-валентными элементами 7 группы следуют элементы 0 группы, и в каждом ряду валентность возрастает от элемента к элементу на 1 единицу, чтобы упасть до 0 в химически недеятельных элементах 0-группы. Сопоставляя число электронов в наружном слое с валентностью, можно притти к заключению, что элементы 0-группы обладают слоем из 8 электронов, отличающимся наибольшей прочностью, слой из 8 электронов не может ни отдавать ни принимать электронов, но на нем может образоваться новый слой электронов из 1, 2, 3 и т.д. электронов. При образовании химическ. соединения из элементов внешний слой электронов вокруг каждого элемента принимает наиболее прочное строение из 8 электронов (см. выше NaCl). Электростатическое притяжение противоположно заряженных атомов удерживает их в пределах кристаллической решотки. Когда хлористый натрий попадает в среду с большой диэлектрической постоянной (например в воду), то электростатическое притяжение настолько слабеет, что происходит распадение кристалла на свободные ионы: Na
+ и С1~. При действии хлора на магний последний отдает 2 электрона двум атомам хлора (каждому по , одному), сам же получает 2 положительных заряда и прочную—8-электронную оболочку, аналогичную оболочке неона. Вокруг же атомов хлора, получивших по 1 отрицательному заряду, образуются оболочки тоже 8-элек-тронные, аналогичные оболочке аргона. Вследствие электростатического притяжения магний соединяется с 2 атомами хлора. Аналогичным способом можно объяснить образование А1С1
3 и др. Со стремлением к образованию прочной 8-электронной системы связана наблюдаемая законность, согласно к-рой все элементы, занимающие 1—4места перед элементами 0-группы (т. е. F, О, N, С и их аналоги), образуют газообразные водородистые соединения. Все эти элементы, получив соответствующее число (1, 2, 3, 4) электронов от атомов водорода, образуют 8-электронную оболочку, как и благородные газы. При элементах же I и II группы 1 и 2 электрона, находящихся в наружной оболочке, слабо удерживаются и, выделяясь, присоединяются к одному или двум атомам водорода. Металл получает положительный заряд, атомы водорода—отрицательный, и образуется твердый солеобразный гидрид, вк-ромводород обладает свойствами металлоида. Равным образом находит объяснение вышеуказанная законность, согласно к-рой сумма электроположительной и электроотрицательной валентности элементов IV—VІI групп равна 8. Например фосфор является трехвалентным по отношению к водороду, от трех атомов к-рого он может получить 3 электрона: внешняя оболочка, в к-рой находилось 5 электронов, становится 8-электронной, и'атом фосфора получает 3 отрицательных заряда, благодаря действию к-рых удерживает около себя 3 положительно заряженных атома водорода. Так можно объяснить строение фосфористого водорода (РН
3). Когда же на фосфор действует хлор (или кислород), то он отдает 5 электронов 5 атомам хлора (каждому по одному), получает 5 положительных зарядов и притягивает 5 электроотрицательных атомов хлора (ср. РС1
5). Таким же способом можно объяснить строение фосфорного ангидрида: 2 атома фосфора отдают 10 электронов (по 5 каждый) 5 атомам кислорода, каждый из к-рых получает по 2 электрона. Т. о. вокруг каждого из атомов фосфора и кислорода образуются 8-электронные оболочки, и атомы фосфора и кислорода, несущие разноименные электрические заряды, образуют прочную молекулу фосфорного ангидрида P
2Q
5. Углерод обладает одинаковой валентностью, равной 4, по отношению как к водороду,, так и к хлору: при образовании метана атом углерода получает от 4 атомов водорода 4 электрона, при образовании четыреххлористого углерода (СС1
4) 1 атом углерода отдает 4 атомам хлора ; по одному электрону. Этой способностью атома углерода как отдавать, так и принимать одинаковое количество электронов можно объяснить постоянную валентность углерода в большинстве углеродистых соединений. Во-• обще максимальная валентность элемента по Отношению к кислороду (Uo) определяется чи-: слом наружных электронов, переходящих к ; атомам кислорода,, валентность же по отноше-; нию к водороду (Х
тн) равняется числу элек-| тронов, которые нужно получить извне (от атома водорода), чтобы число электронов в наружной оболочке достигло восьми. ясно: Uo + U
H = 8. Но нужно'указать. правило не соблюдается, когда атом да не отдает электрон, а получает, как это имеет место при образовании гидридов щелочных и щелочноземельных металлов. Теория строения атома элементов приводит как необходимое следствие к следующему числу химических элементов в каждом периоде П. с. э.: в I—2, во II и III по 8, в IV и V по 18, в VІ и VІI по 32, что и наблюдается на самом деле, за исключением последнего, седьмого периода, где известно только несколько первых его членов. Бор на основании теоретических положений указал совершенно точно число элементов в каждом периоде и дал объяснение, почему это число именно такое, как приведено, Отсюда | подробностях, укажем, что при образовании что это .! этих элементов новые электроны вступают в водоро- | четвертый (считая снаружи) слой электронов, а три слоя, лежащих над ним, будут заключать у всех этих элементов одинаковое число электронов. В результате все эти элементы должны быть почти тождественными: все они должны быть трехвалентными по числу электронов, находящихся в самом наружном слое, и они будут мало различаться по хим. свойствам. Т. о. для 15 металлов редких земель нашлось место, тогда как ранее не знали, куда их поместить в П. с. э.: они занимают те места в системе элементов , к-рые и должны занимать по расположению электронов в атоме, т. е. все один за другим в III группе, в 8 ряду, последовательно места 57—71.
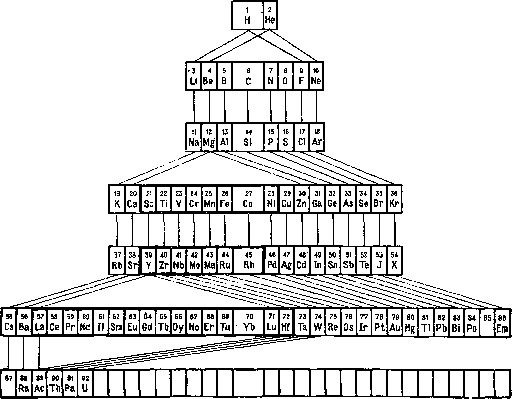
а не другое. На рисунке представлено расположение элементов в новой форме П. с. э., предложенной впервые Томсеном (Thomsen). Каждый период элементов расположен в горизонтальном ряду. Элементы, образовавшиеся нормально, ничем не отмечены; образовавшиеся ненормально заключены в черную рамку, причем во втором ряду снизу в черную рамку заключены элементы вдвойне ненормальные. Элементы, обладающие сходными свойствами, соединены линиями; таким образам легко проследить группу щелочных металлов, группу щелочноземельных металлов, группу галоидов и т. д. При нормальном порядке образования следующего нового элемента прибывающий электрон помещается на самой внешней орбите и входит в состав группы валентных электронов, определяющих валентность атома. Валентность такого элемента будет отличаться на единицу от валентности предыдущего. При ненормальном порядке новый электрон становится на одну из уже образовавшихся в предыдущем периоде орбит, т. е. не на внешнюю, а на внутреннюю. Вследствие этого число внешних электронов для нек-рого числа последовательных элементов остается одним и тем же—следовательно и их валентность и их хим. свойства должны быть близкими между собой. Это наблюдается в средине IV и V периодов, где мы имеем Fe, Со, Ш и Ru, Rh и Pd. Наибольшее влияние ненормального порядка вступления новых электронов должно сказываться на элементах «вдвойне ненормальных», находящихся в VІ периоде. Не останавливаясь на
Лит.: КурОатов В., Закон Д. И. Менделеева, Л., 1925; Менделеев Д., Периодический закон, М.—Л., 1926; он Hie. Основы химии, т. II, изд. 9, М.—Л., 1928; Ч у г а е в Л., Периодическая система химических элементов, М., 1913; Antropoff A., Atlas der physikalischen u. anorganischen Chemie, Lpz., 1929; Lyon D., Das periodlsche System in neuer Anordnung, 1928; Rabinbwitsch E.u. Thielo, Periodisches System d. Elemente— Geschiclite und Theo-rie, Stuttgart, 1930.
И. Каблуков.
 Смотрите также:
Смотрите также:
- ПЕРИОДИЧЕСКИЕ ПСИХОЗЫ, понятие, имеющее в наст, время лишь историческое значение. Под П. п. подразумевалась группа псих, заболеваний, чрезвычайно различных по своим клин, проявлениям, но обладающих одним и тем же общим признаком, ...
- ПЕРИОСТИТ (periostitis), воспаление надкостницы, представляет собой довольно распространенное явление в патологии костной системы. По клин, течению П. делятся на острые (подострые) и хронические; по пат.-анат. картине (а отчасти и на основании ...
- PERIPLOCA GRAECA L OCA GRAECA ., периплока, обвой-ник греческий, многолетняя лиана семейства Asclepiadaceae, распространенная по берегам Черного и Средиземного морей, на Кавказе и в Малой Азии. Корневище цилиндрической формы дает начало нескольким тонким ...
- ПЕРИСПЛЕНИТ, воспаление капсулы селезенки, не имеет самостоятельного значения, т. к. зависит от соответствующих изменений либо селезенки, либо брюшины, либо левой плевральной полости, либо соседних органов (левая почка, толстая кишка, желудок, ...
- ПЕРИСТАЛЬТИКА (от греч. peristaltikos— охватывающий), особая форма мышечного-сокращения, наблюдаемая гл. обр. в полых органах, снабженных гладкой мускулатурой. Перистальтическое движение состоит в том,, что ритмические сокращения, приводящие к уменьшению просвета органа, распространяются ...

 Смотрите также:
Смотрите также: