КРОВЬ
КРОВЬ, жидкость, заполняющая артерии, вены и капиляры организма и состоящая из прозрачной бледножелтоват. цвета плаз- мы и взвешенных в ней форменных элементов: красных кровяных телец, или эритроцитов, белых, или лейкоцитов, и кровяных бляшек, или тромбоцитов. В филогенетическом ряду животных К. впервые, хотя и несовершенно, отделяется от межтканевой жидкости одновременно с появлением кровеносной Системы —- у эхинодерм и аннелид; в теле человеческого эмбриона К. появляется на 3—4-й неделе одновременно с зачатками сосудов и внутри их. Как эти зачатки, так и первичные форменные элементы К. происходят из, мезодермы (см.
Кроветворение).— Несмотря на то, что многие авторы продолжают еще говорить о «кровяной ткани» с жидким межуточным веществом, термин «ткань» отнюдь нельзя признать применимым к К., которая отличается от любой другой ткани гл. обр. тем, что место образования ее морфол. элементов и составных частей плазмы находится не в самой К., а вне ее. Вместе с лимфой (к-рую между прочим никто -тканью не называет) К. представляет внутреннюю среду для всех элс-mi нтов нашего тела, к-рую все органы и ткани пополняют продуктами своей жизнедеятельности, а нек-рые органы, как костный мозг, селезенка, лимф, железы и пр. (см.
Кроветворение), еще и образующимися в них форменными элементами. Поступившие в К. форменные элементы продолжают в не й жить и функционировать до тех пор, пока обусловленные их деятельностью или возрастом изменения структуры не достигнут такой степени, что сделают возможным их захват и разрушение эритролитическими и лейко-литическими органами (см.
Гемолиз). Допускаемый нек-рыми авторами физиологич. распад эритроцитов и лейкоцитов в токе К. пока еще остается недоказанным, т. ч. и в этом отношении К. отличается от всех тканей организма. К. отличается от других частей внутренней среды, т. е. лимфы и межтканевой жидкости, не только по составу и по нахождению в сосудах, но и по непрерывной и быстрой циркуляции по сосудам, обусловленной деятельностью сердца (см.
Кровообращение). Протекая через капиляры, К. входит через их стенки в соприкосновение со значительной частью клеток организма; там, где клетки не соприкасаются непоерв дствшно с капилярами, связь между ними и кровью устанавливается через посредство омывающей их межтканевой жидкости. В легких, где капиляры прикрыты лишь тончайшим слоем альвеолярного эпителия, К. входит в близкое соприкосновение с находящимся в альвеолах воздухом. На всем протяжении громадной капилярной сети происходит беспрерывный обмен веществ между тканями и К. через стенки капиляров. В нее беспрерывно поступают из воздуха и из ткан й газы, вода, неорганические и органич ские соединения, являющиеся продуктами п-р; варивания пищевых веществ, внутренн й секреции тканей, диссимиляционных процессов, жизнедеятельности попавших в организм или населяющих его бактерий и т. д. Все эти вещества током К. разносятся по всем частям тела и на соответствующих участках с го переходят вновь из К. в тканевые клетки, для к-рых являются, смотря по обстоятельствам, питательным материалом, стимулирующими, тормозящими или ядовитыми агентами, или материалом, накапливающимся в качестве резервов, или наконец для выделения из организма. В сочетании с упомянутой выше быстротой оборота крови это заставляет признать ее, наряду с нервной системой, важнейшим фактором, поддерживающим единство организма и обусловливающим взаимодействие его бесчисленных составных элементов, достигшее в процессе естественного отбора изумительной по своему совершенству согласованности. Тот же обмен веществ между К. и тканями в сочетании с кровообращением обусловливает кроме функции связи и все остальные функции К., которые теснейшим образом переплетаются между собой и с функциями всевозможных органов и тканей тела и в к-рых лишь весьма условно можно разграничить функции питания тканей, удаления продуктов диссимиляции, снабжения кислородом, поддержания необходимых для жизнедеятельности клеток физ.-хим. свойств тканевой среды, ее активной реакции и осмотического давления. У б. или м. высокоорганизованных животных все воспринимаемые ими из внешней среды питательные вещества доставляются из пищеварительного тракта в ткани исключительно через посредство К. Ее роль не сводится при этом к одному лишь механическому подвозу продуктов пищеварения к местам их потребления: изменения ее химизма и физ.-хим. свойств являются активными факторами как при переходе этих продуктов в кровь, так и при последующем переходе из К. в ткани. Так, обеднение К. сахаром, повышение содержания молочной кислоты и сдвиги в системе электролитов вызывают в тканях определенного участка тела химич. процессы, протекающие в сторону приближения хим. констант К. к средней норме (распад гликогена с отдачей сахара в ток оттекающей К., ре-синтез молочной к-ты с уменьшением количества ее в оттекающей К. и т. д.). Точно так же обстоит дело и с теми веществами, к-рые, являясь продуктами жизнедеятельности или распада одних органов, необходимы другим органам для выполнения их специфических функций: инкреторных или экскреторных функций, межуточного обмена и т. д.; и здесь обмен происходит при самом активном, участии физ.-хим. механизмов К. Наконец многочисленные питательные вещества, поступив из кишечника в кровь, прежде чем перейти в ткани, подвергаются разнообразным превращениям в самом токе ее; частью под влиянием ферментов и форменных элементов крови, частью через посредство более или менее лябильных соединений с ее составными частями продукты пищеварения переводятся в состояние, допускающее их дальнейшее усвоение клетками организма, или освобождаются от тех или иных токсических свойств. Среди органов, которым К. подвозит необходимые для их специфической функции вещества, находятся и такие, через к-рые из организма удаляются всякого рода «отбросы производства», продукты диссимиля- ции и распада, накопление к-рых в организме могло бы повлечь за собой вредные для него последствия. Здесь К. играет наряду с питательной ролью и роль очистительную, причем и при выполнении этой функции дело не сводится к одному лишь механическому подвозу, а сопровождается рядом сложнейших процессов физ.-хим. характера, протекающих в самой крови. Коллоидальное состояние белков К. и их осмотическое давление, состояние буферных свойств крови, соотношение в ней электролитов и многое другое имеют решающее значение для деятельности любого секреторного и экскреторного органа, в том числе и почек и потовых желез и т. д. Через посредство К. происходит и весь газообмен нашего организма. В основном этот обмен обусловлен различиями в напряжении 0
2 и С0
2 в альвеолярном воздухе и в тканях с одной стороны, в артериальной и венозной К.—с другой. Но самый процесс обмена происходит не в порядке простого растворения газов в К. на одних участках кровеносной системы и их выделения на других, а путем их вступления в лябильные хим. соединения с составными частями К. В легких 0
2 соединяется таким образом с НЬ эритроцитов, образуя оксигемоглобин; в тканях часть поступающей в кровь С0
2 связывается основаниями плазмы, с к-рыми образует бикарбонаты, но частью остается и в свободном со состоянии согласно формуле
бикарб;нат= К (константа). А т. к. увеличение содержания в крови СО
2 (а также и других к-т, поступающих из тканей) меняет агрегатное состояние гемоглобина и понижает его способность связывать 0
2 (Barcroft), то при прохождении К. через капиляры создаются условия, значительно способствующие отщеплению 0
2 из оксигемоглобина и переходу его в ткани. Обратный процесс имеет место в легких, где содержание свободной С0
2 в К. резко падает, способность НЬ связывать О
а благодаря этому повышается и тем самым облегчается образование оксигемоглобина; в этом же направлении действует еще и ряд других факторов (происходящие под влиянием колебаний свободной СО
а перемещения ионов хлора из плазмы в эритроциты и обратно, сгущение К. в артериальной части капиля-ров и разжижение ее в венозной и т. д.). Все это показывает, что и в функции газообмена, так же как и в других функциях крови, принимают активное участие все ее составные части и что все составные элементы этого процесса находятся между собой в теснейшей связи и в постоянном взаимодействии. Нормальное функционирование любой живой клетки обусловлено определенным физ .-хим. состоянием окружающей ее среды, сравнительно небольшие изменения к-рой уже влекут за собой нарушение жизнедеятельности клетки. Особенно чувствительны к изменениям среды высокодиференцированные клетки высших животных, погруженные в отделенную многочисленными барьерами от внешнего мира «внутреннюю среду», в к-рой благодаря своей подвижности главную роль играет К. Отсюда—биологич. необходимость постоянства главнейших составных элементов и свойств крови, из которых здесь можно упомянуть постоянство ее активной реакции (рН), осмотического давления, состава электролитов. А т. к. непосредственный ток проходящих через К. веществ, с одной стороны, и ряд процессов, протекающих в самих составных элементах ее,—с другой, действуют в прямо противоположном направлении, то в процессе естественного отбора возникло множество приспособлений, автоматически нейтрализующих все эти вредные влияния, выравнивающих отдельные колебания и ограничивающих их размах известными пределами. Так, в отношении рН крови главным регулирующим фактором являются входящие в ее состав карбонаты и др. буферные смеси, равно как обладающие буферными свойствами белки и НЬ (см.
Буферные свойства). Существенную помощь оказывает при этом деятельность легких и почек, реагирующих изменениями вентиляции и экскреции на малейшие изменения рН и кислотно-щелочного равновесия К.- Участвуют в этой регуляции и печень (через посредство отщепляющегося в ней от аминокислот аммиака), и многочисленные пищеварительные железы, выводящие из К. при своей секреции кислые и основные ионы, и ряд других органов. Постоянный уровень осмотического давления в К. поддерживается гл. обр. почками, а также легкими и потовыми железами. Немалую роль играет и способность рыхлой межуточной ткани быстро вбирать в себя и отдавать в К. значительные количества воды и солей; принимают участие и коллоиды К. (благодаря своей способности связывать воду) и высота кровяного давления, обусловленная расширением или сужением сосудов, а также железы внутренней секреции и т. д. Примерно таким же образом регулируется наконец и соотноошение электролитов плазмы, имеющее громадное значение для деятельности всех органов тела. Во всех этих регуляциях играет огромную роль вегетативная нервная система, чрезвычайно чувствительная к колебаниям рН и электролитов и отвечающая на эти колебания соответствующими рефлексами на различные органы: легкие, почки, железы, сосуды и т. д. Значительным постоянством отличается и содержание форменных элементов в К. здорового человека. Особенно отчетливо выделяется это постоянство в отношении эритроцитов; если те физиол. колебания, к-рые наблюдаются при их подсчете в периферической К. в разное время дня, после питья, движения и т. д., зависят отчасти от реального изменения циркулирующей массы К. в организме (см. ниже—масса крови), то все же число эритроцитов в определенных стандартных условиях (натощак, при полном постельном покое) представляется величиной, в значительной степени постоянной для данного индивидуума. При этом, как и все остальные константы К., содержание в ней эритроцитов представляет собой динамический результат беспрерывно протекающих в организме противоположно направленных процессов—в данном случае процессов новообразования и распада эритроцитов. Эти процессы находятся между собой в теснейшем взаимодействии, взаимно друг друга стимулируют или тормозят. Известно, что усиление гемолиза влечет за собой усиленную кроветворную деятельность костного мозга, а стимулирование последней—усиление гемолиза, что подавление распада эритроцитов сопровождается понижением эритропоэза и наоборот; однако вследствие недостаточности наших познаний о распаде эритроцитов и дальнейшей судьбе продуктов этого распада (см.
Гемолиз), равно как о вызревании эритроцитов и переходе их в К. (см.
Кроветворение), самый механизм взаимодействия между этими процессами остается пока еще неясным. Некоторую роль играет при этом повидимому стимулирующее действие, оказываемое на костный мозг продуктами расщепления НЬ и стромы эритроцитов. Несомненное участие принимают в регуляции состава красной К. железы внутренней секреции и в частности щитовидная и половые железы, равно как и селезенка; большое влияние оказывает на состав крови газообмен организма, а в последнее время стала выявляться и роль кислотно-щелочного равновесия. Наконец все более очевидным становится значение питания в поддержании нормального состава крови причем речь не идет уже об одном лишь железе, как это было еще сравнительно недавно, а о более сложных животных и растительных продуктах, например: об аминокислотах, экстрактивных веществах, витаминах и т. д. Еще менее изученной и еще более сложной является регуляция содержания в К. лейкоцитов. Правда, общее количество лейкоцитов менее постоянно, чем количество эритроцитов, но тем более разительной является стойкость, с к-рой у каждого индивидуума сохраняется определенное соотношение между различными видами белых кровяных телец, так называемая
лейкоцитарная формула (см.). Аналогично тому, что мы видели в отношении эритроцитов, и здесь играет повидимому крупную роль взаимодействие между распадом и регенерацией; однако множественность форм лейкоцитов заставляет предполагать наличие здесь гораздо более сложного регулирующего механизма. Выяснению его немало , препятствует отсутствие окончательного решения по вопросу о множественном или едином происхождении различных лейкоцитарных видов (см.
Кроветворение). Кроме того изучение механизма регуляции осложняется здесьприсущейбелым тельцам активной подвижностью и проявляющимся при этом хемотаксисом и тропизмами, а также значительностью лейкоцитарных резервов в селезенке, лимф, железах, костном мозгу и т. д., играющих по отношению к циркулирующим лейкоцитам гораздо большую роль, чем соответственные резервы эритроцитов. Многочисленные факты свидетельствуют о влиянии на лейкоцитов химизма К., деятельности желез внутренней секреции и вегетативной нервной системы. Однако каких-либо определенных закономерностей здесь еще установить не удалось. — Нельзя нако- нец не отметить того упорства, с которым в организме сохраняется общая масса его К. У различных индивидуумов она варьирует в довольно значительной степени и притом как в своем абсолютном, так и в относит, выражении (см. ниже—Общая масса К.). Но у каждого отдельного индивидуума абсолютная масса К. [т. е. сумма циркулирующей и резервной К. (см.
Кровообращение)] представляет весьма стойкую величину, обнаруживающую лишь незначительные фи-зиол. колебания в связи с питьем, движением и т. п. Она сохраняется в значительной степени неизменной и при различных патологических состояниях: и при похудании и при ожирении (отсюда повышение, resp. понижение ее относительных цифр), при анемиза-ции (убыль эритроцитов компенсируется нарастанием плазмы), после кровотечений. Самый механизм этих регуляций остается пока неизвестным. Особое место, занимаемое кровью в общей экономии организма в качестве внутренней среды его, и описанные выше особенности ее физиологии определяют и особенности ее патологии. Т.к. кровь не является тканью и но обладает ни определенной структурой ни размножающимися и развивающимися внутри ее самой элементами, то среди ее пат. изменений не находят себе места никакие процессы, связанные с существованием ткани как таковой: в ней не наблюдаются ни явления воспаления, ни атрофии или гипертрофии, ни опухоли, ни импрегнации или инфильтрации, ни наконец некроза или гангрены. Пат. изменения, в том или ином отношении напоминающие какой-либо из этих процессов (лейкоцитоз—воспаление, лейкемия—опухоль), представляют собой в действительности лишь отражение соответствующих процессов, происходящих либо в кроветворных органах либо на других участках организма. Даже явления дегенерации, наблюдаемые в форменных элементах крови, возникают в громадном большинстве случаев не во вр< мя npi бывания этих элементов в К., а еще до их поступления в нее, в кроветворных органах. Разнообразнейшие изменения картины белой крови, всякого рода лейкоцитозы, лимфоцитозы, сдвиги влево или вправо (см.
Лейкоцитарная формула), алейкии, агранулоцитозы, лимфатические, миелоидные, моноцитарные, миело-бластические лейкемии и т. д. зависят не от изменения или пат. роста циркулирующих в К. элементов, а от пат. изменений в лей-копоэтических и лимфопоэтических органах, от усиления или ослабления их функций под влиянием разного рода воздействий. Громадное большинство анемических состояний также зависит от вызванных разными причинами нарушений деятельности эритро-поэтических или эритролитических органов в сторону ли ее усиления или ослабления; то же относится к гипррглобулиям разного происхождения. Исключением из этого правила являются те заболевания, при к-рых форменные элементы К. разрушаются или повреждаются в самом токе ее проникшими в него вредными агентами. Сюда относятся такие паразитарные заболевания, как малярия и нек-рые др. (см. ниже—паразиты К.), септицемии с гемолитическими возбудителями, отравления гемолитическими, повреждающими гемоглобин эритроцитов ядами (СО, КСЮ
3, анилин). Сюда же можно отнести гемолиз эритроцитов при пароксизмальной
гемоглобинурии (см.), обусловленный наряду с другими факторами наличием в К. гемолитического амбоцептора. Вредное или разрушающее влияние на циркулирующие в К. форменные элементы оказывают и нек-рые физ. факторы, как напр. перегревание (солнечные ванны), рентгеновские лучи. В зависимости от своей интенсивности и продолжительности действия эти и подобные им факторы могут повлечь за собой различные изменения состава К., равно как физ .-хим. и морфол. изменения самих форменных элементов, однако и при этом мы не встретим в К. реакций, сходных с наблюдаемыми в тканях при аналогичных повреждениях или разрушениях их элементов. Единственная активная реакция, которую можно при этом Наблюдать со стороны циркулирующих форменных элементов, заключается в фагоцитозе лейкоцитами возбудителей инфекции и поврежденных телец или их обломков; регенерация же форменных элементов происходит не в самой К., а в кроветворных органах, стимулируемых продуктами распада поврежденных телец, недостатком кислорода или другими неизвестными нам путями. Если же инфекция, токсин, яд и т. д.парализовали деятельность и этих органов, то состав К., предоставленной самой себе, б. или м. быстро ухудшается вплоть до наступления летального исхода. Еще в меньшей степени можно говорить об эндоваскулярно обусловленных пат. изменениях.плазмы. Если не считать небольшого влияния, оказываемого лейкоцитами на содержание в ней ферментов и иммунных тел, то все пат. изменения как хим. составных частей плазмы, так и ее физ .-хим. свойств (изменения состава электролитов, липоидов, билирубина, мочевины, остаточного азота, фенолов, сахара, ацетона, резервной щелочности, редкие изменения рН, изменения свертываемости и т. д.) определяются деятельностью всевозможных органов и тканей тела, к-рые либо выделяют в К. пат. продукты или же нормальные продукты, но в патологически измененных количествах, либо не удаляют из К. евсевременно и в достаточных количествах продуктов обмена веществ, либо не доставляют К. необходимых веществ. Все это относится и к пат. изменениям, наблюдаемым при генотипиче-ских заболеваниях К., к-рые представляют собой в действительности либо заболевания кроветворных органов, либо органов, регулирующих кроветворение, либо наконец органов, снабжающих К. какими-либо необходимыми для ее нормального состояния веществами. Так напр. при наследственной гемолитической ж°лтухе locus morbi находится либо в костном мозгу, выпускающем в кровь пат. эритроциты, либо в' селезенке, гемолитическая функция которой чрезмерно усилена: злокачественное малокровие, значительная часть случаев которого является генотипической, обусловлено неправильной функцией костного мозга; наконец от недостаточного поступлшия из тканей тромбокиназы зависит повидимому и отсутствие свертывания крови при гемофилии. Точно так же обстоит дгло и в части случаев хлороза, где имеется эндокринно обусловленная недостаточная функция костного мозга. В виду этих особенностей патологии К. можно утверждать, что патолог, изменения К. являются лишь симптомами заболеваний других органов или тканей. Заболевания центр, нервной системы и особенно вегетативных центров, регулирующих процессы обмена веществ, дисфункции желез внутренней секреции, заболевания почек, печени, поджелудочной железы, органов пищеварения и дыхания, расстройства кровообращения вследствие анатомических изменений или фнкц. недочетов сердца и сосудов, всевозможные воспалительные процессы, нагноения и т. п.—словом любое патол. изменение любой части организма отражается на тех или иных хим. составных частях плазмы, на физ.-хим. свойствах ее, на количестве содержащихся в К. форменных элементов и на их качественных особенностях. К. оказывается т. о. как бы «зеркалом организма», в к-ром находят до нек-рой степени свое отражение все протекающие в нем фи-зиол. и пат. процессы. Отсюда громадный неослабевающий интерес, с к-рым изучаются мельчайшие, казалось бы, детали, касающиеся К. (см.
Гематология) и в частности ее физ.-химич. свойств. Необходимо однако предостеречь от нередко наблюдаемого при этом чисто механического взгляда на связь между К. и остальным организмом, согласно к-рому отражение должно в точности «копировать» морфол. и физ.-химич. изменения органов, равно как и от основывающихся на этой же точке зрения выводов о функциях различных органов. Сторонники этих взглядов упускают из виду чрезвычайную стабильность основных свойств К. и многосторонность ее связей, вследствие к-рых то или иное воздействие на нее м. б. нейтрализовано как таковое, но зато различными путями может оказать влияние на менее устойчивые составные элементы или свойства. Напр. введение солей не отразится заметным образом на осмотическом давлении К., но зато повысит содержание воды в ней и понизит уровень эритроцитов и НЬ; введение к-т в известных пределах не повлечет за собой изменений рН крови, но отразится на резервной щелочности или повлечет за собой нарастание количества эритроцитов и т. и. Благодаря антагонистическому характеру функций и регуляций организма и отнюдь не абсолютной, хотя и весьма совершенной их согласованности нередки и такие случаи, когда результат какого-либо воздействия оказывается парадоксальным, когда напр. введение сахара понижает уровень его в К., поступление гемолитических веществ влечет за собой увеличение количества эритроцитов, а подавление гемолиза—понижение этого количества. Словом, в отношении К., как и в отношении др. аналогичных явлений, зеркальность следует понимать не в смысле тождества отражения и отражаемого, а в смысле нек-рого соответствия между отражаемым и изменениями отражающего предмета. Из всего изложенного вытекает, что при изучении влияния на К. деятельности какого-либо органа следует: 1) учитывать и качеств иное и количественное состояние не только этого органа, но и К.; 2) не ограничиваться исследованием одного лишь возможного непосредственного эффекта (напр.содер-жания молочной к-ты в К. при мышечной работе), а захватывать возможно больший комплекс элементов К. (щелочный резерв, эритроциты, лейкоцитарная формула и мн. др.), так или иначе связанных с непосредственным продуктом деятельности исследуемого органа. И наоборот, при выяснении причин того или иного изменения К. не следует ограничиваться поисками одной лишь возможной непосредственной причины (напр. гемолиз или кровотечение при аньмизации), а всегда иметь в виду и возможность более отдаленных и косвенно влияющих факторов (в данном примере—качественно неполноценное питание, токсическое торможение костного мозга, ненормальности половой жизни и т. д.). Наконец следует всегда помнить, что все явления, протекающие в организме , и в том числе те, к-рыми вызываются изменения К. и ее элементов, представляют собой единство процессов, взаимно друг друга обусловливающих, стимулирующих или тормозящих. Поэтому при выяснении патогенеза того или иного пат. явления в К. нельзя ограничиваться установлением одного лишь из определяющих его факторов (напр. степени гемолиза при анемии, изменений протоплазмы эритроцитов при изменениях их резистентности), а следует выявлять и соответствующий противоположный фактор (регенеративную деятельность костного мозга, resp. состояние ядерного вещества в эритроцитах) и характер и механизм существующей между этими факторами связи. При этом должны учитываться и качественные и количественные особенности факторов и взаимная зависимость тех и других, вследствие к-рой действие какого-либо фактора может оказаться совершенно различным, если различна его интенсивность. Так напр. идентичные токсины, нагноительные процессы, микроорганизмы могут в одних случаях вызывать лейкоцитоз, в других—лейкопению; такие явления следует всегда заранее предвидеть и включать их изучение в план соответствующего исследования уже при постановке проблемы. Трлько при соблюдении этих методологических условий найдут себе соответствующее место и разрешение многочисленные противоречия, которыми изобилует наука о крови и которые являются одним из элементов общего кризиса медицины.
Я. Черняк. П. Сравнительная физиология К. беспозвоночных. Поскольку определение понятия кровь не представляет трудности в случае позвоночных, постольку оно становится затруднительным при попытке охватить отношения, наблюдающиеся во всем животном мире, включая сюда и бзепозвоночных. Основное затруднение заключается в том, что при определении понятия К. необходимо принять во внимание с одной стороны взаимоот- ношения между циркулирующими жидкостями и кроветворными органами, а с другой— их отношение к кровеносной систем! . Кроме того это определение усложняется необходимостью уточнить в каждом данном случае границу между К. в собственном смысле и лимфой с одной стороны и интерстициаль-ной кровяной жидкостью—с другой. Это затруднение вызвано тем, что не у всех животных существует топографическое разделение кровеносной и лимф, систем, а стало быть не у всех можно провести резкую грань между кровью и лимфой. Правда, в тех случаях, когда отдельной лимф, системы нет или когда она представлена незамкнутой сетью сосудов, место лимфы занимает тканевая жидкость, циркулирующая целиком или отчасти в лимфатических щелях и заполняющая полости тела. Наиболее простые отношения наблюдаются у кишечнополостных(Coelente-rata), у к-рых не существует даже разделения между кровеносной и пищеварительной системами и где функции не только пищеварительные и кровеносные, но также дыхательные и выделительные несет общая гастро-васкулярная система, разветвляющаяся по всему организму. Т. о. у этого класса животных нет никакой возможности провести границу между кровью и пищеварительной жидкостью в широком смысле этого слова, т. к. в гастро-васкулярной системе циркулирует морская вода, содержащая клеточные элементы крови, а возможно и растворенные дыхательные пигменты и кроме того кислород, пищевые частицы, пищеварительные ферменты, продукты переваривания и выделения, половые и другие клетки. Т. о. у кишечнополостных К. по существу не отделима от химуса и хилуса.—Однако уже у иглокожих (Echinodermata) кровеносная система отделяется от пищеварительной, а в связи с этим и К. приобретает у них более специальное и самостоятельное значение, хотя и у этой группы еще нельзя провести строгой границы между жидкостями, наполняющими собственно кровеносную систему, а также систему водоносную и общую полость тела. Впрочем водоносная система, основная функция которой механическая, несет повидимому—по крайней мере отчасти—и функции газообмена, а также выделительную функцию. По мере поднятия в системе животного мира обособление кровеносной системы и К. от прочих систем и жидкостей организма и их функций становится полнее. Одновременно с этим происходит постепенная выработка самостоятельных дыхательной и выделительной систем. Процесс фнкц. специализации крови происходит повидимому весьма постепенно, и у нек-рых иглокожих, обладающих с одной стороны самостоятельной кровеносной системой, а с другой—имеющих гемоглобиНсодержащие эритроциты, последние содержатся не в кровеносной системе, а в водоносной, где вследствие непосредственной связи с окружающей средой условия для газообмена более выгодны, чем в самой кровеносной системе. Т.о. водоносная система, содержа жидкость, окрашенную гемоглобином, несет дыхательную функцию и аналогична малому кругу кровоооращения у позвоночных, а кровеносная система, рас-пред: ляя по организму продукты всасывания из кишечника, соответствует лимф. системе позвоночных. При этом прежде всего происходит отделение пищеварительной системы от кровеносной, в то время как связь последней с общей полостью тела, а также с системами выделительной и половой и с их функциями сохраняется еще на сравнительно высоких ступенях филогенетической системы; так напр. общая полость тела червей рода Sipunculus нацело отделена от пищеварительной системы, но при отсутствии обособленной кровяной системы несет функции этой последней, причем одновременно с функцией дыхания несет и функции выделения. В последнем отношении К. сипунку-' лид особенно замечательна. Помимо настоящих ядерных эритроцитов, содержащих НЬ, в ней встречаются также типичные для кровяной жидкости лимфоидные клетки. Кроме этого в ней имеются еще своеобразные урны, к-рые представляют собой одноклеточные полые чаши с ресничным краем, быстро движущиеся в полости тела. Функции этих урн весьма многообразны. Обладая активной подвижностью, они приводят в движение всю массу эритроцитов, к-рые в силу своего высокого удельного веса постоянно оседали бы на дно полости тела. Т.. к. у сипункулид отсутствуют сердце и какие бы то ни было сократительные сосуды, то полагают, что деятельность урн заменяет их в этом отношении и, поддерживая эритроциты в постоянном движении, способствует их газообмену (Cuenot). С другой стороны установлено, что из отверстия урн выделяется слизистое вещество, обволакивающее посторонние частицы, попадающие в сферу их действия. В дальнейшем все такие частицы вовлекаются в полость урн, где и перевариваются. Т.о. урны являются определенно экскреторными элементами, освобождающими организм от продуктов распада. В этом отношении они могут считаться аналогичными нефростомам, т. е. неподвижным выделительным воронкам других кольчатых червей. Поскольку же урны служат не для выведения наружу частиц, подлежащих удалению из организма, но для их переваривания, они аналогичны и фагоцитам (Cuenot, Cantacuzene). Наконец необходимо отметить, что в той же полости тела взвешены и половые элементы, проходящие тут же все стадии своего развития. Лишь начиная от моллюсков и членистоногих наступает окончательное обособление кровеносной системы от прочих систем организма, освобождение ее от всех посторонних функций и ее специализация на газообмене. Дыхательные пигменты позвоночных окрашены в красный цвет и связаны с эритроцитами. У беспозвоночных красные пигменты, соответствующие НЬ, встречаются очень редко, зато у них встречаются пигменты (желтые, коричневые, зеленоватые и синие), к тому же у беспозвоночных они лишь в редких случаях связаны с эритроцитами, а б.ч. растворены в кровяной сыворотке. Кроме того необходимо отметить, что коллоиды кровяной жидкости моллюсков и членистоногих находятся в состоянии ги-дросола и т. о. соответствуют не столько сывороточным белкам крови позвоночных, сколько гемоглобину (Bottazzi; 1922). От этого обстоятельства зависит и различие в нек-рых физ.-хим. свойствах К. позвоночных и беспозвоночных. В виду того что у последних дыхательные пигменты растворены в кровяной сыворотке, последняя несравненно богаче белковыми веществами, чем плазма К. позвоночных. Поэтому и нельзя сравнивать цифры, относящиеся к сыворотке позвоночных, с соответствующими цифрами, найденными для беспозвоночных, т. к. во многих случаях, как напр. у моллюсков и ракообразных, содержание белка в одной жидкой части К. соответствует его содержанию в цельной К. позвоночных.-— Что касается минерального состава К. различных животных, то следует отметить, что у морских беспозвоночных минеральный состав К. вполне сходен с минеральным составом морской воды. Данные по кровеносной системе и крови по отдельным классам. Губки (Spongiae) и кишечнополостные (Coelenterata). Специальной кровеносной системы не имеют. Последняя представлена общей кише чнополостной системой, к-рая заполнена бесцветной нрсвертываю-щейся жидкостью, содержащей небольшое-количество зернистых лейкоцитов. По своему хим. составу их К. близка к морской воде
(А морской воды 2,2°С,
Л гастро-васкуляр-ной жидкости 2,195°С). У многих кишечнополостных гастро-васкулярная жидкость свободна от белковых веществ и не содержит дыхательных пигментов. Кислород воды поглощается непосредственно клетками тканей. У других представителей этой группы найден дыхательный пигмент тетронэритрин (Merejkowsky; 1881). Зернистые форменные элементы, которые изучены очень мало, в общем вполне сравнимы с соответствующими клетками высших групп. С филогенетической стороны важно, что блуждающие клетки появляются в полостной жидкости уже у тех животных, у к-рых крови в собственном значении этого слова еще нет, т. е. когда К. представлена по существу морской водой, не содержащей коллоидных веществ. Иглокожие (Echinodermata). Обладают рядом с полостью тела и водоносной системой обособленной кровеносной системой, из к-рых последние две наполнены жидкостью одинакового состава—прозрачной, окрашенной или бесцветной, содержащей 1—2% способных к свертыванию альбуминоидов, большое число зернистых амебоидных клеток, снабженных желтым или фиолетовым пигментом, к-рый повидимому дыхательных функций не несет. Зернистые клеточные элементы несут повидимому фагоцитарно-экскреторные функции. У нек-рых иглокожих (Ophiuroidea) обнаружены безъядерные эритроциты размером lVs—20
/л, желто-розового цвета, обусловливающего в массе красную окраску К. Пигмент эритроцитов дает две абсорпционных полосы ок-сигемоглобина, но в виду того что кристаллы гемина из него еще не получены, нельзя с полной уверенностью отождествлять этот пигмент с НЬ и приписывать ему дыхательную функцию (Foettinger, 1880; Ludwig-Hariiann, 1901). У морских ежей наряду с неокрашенными амебоидными клетками встречаются клетки с зернистостью красно-коричневого цвета, обусловленного присутствием особого пигмента — эхинохрома (Мс Munn; 1885, 1889), являющегося повидимому железосодержащим липохромом, к-рому нек-рые авторы приписывают дыхательную функцию (Gedder ;1880). Состав эхинохрома определяется как С
102 H
99N
12FeS
2 0
12, причем отмечено, что кипячением с минеральными к-тами его удается перевести в гема-топорфирин, что указывает на его родство с Hb (Griffiths; 1892). Другие авторы считают эти данные недостаточно доказанными (Win-terstein, 1909; Bottazzi, 1922). У нек-рых голотурий (Echinodermata) встречаются помимо незернистых и зернистых (окси- и базо-фильных) лейкоцитов также и эритроциты диаметром до
30/л, содержащие красный пигмент, повидимому вполне соответствующий НЬ как химически, так и спектроскопически. От НЬ позвоночных этот НЬ отличается лишь более низкой точкой свертывания (58—60°С) (Howell; 1885). С точки зрения сравнительной физиологии К. чрезвычайно существенным представляется процесс свертывания К. иглокожих; при этом наблюдается очень характерная аглютина-ция форменных элементов К., выпускающих длинные нитевидные псевдоподии, к-рыми они и анастомозируют, образуя объемистые «плазмодии». Полного свертывания у иглокожих впрочем не бывает, однако наблюдается выпадение нитей и образование сетчатого сгустка, отличающегося весьма сильной ретрактильностью. У морских ежей цельная К. имеет красновато-желтый цвет; после выпадения сгустка над ним образуется слой бесцветной плазмы. В парафинированной посуде свертывания не наступает. Попытки обнаружить в полостной жидкости растворимый протеин, аналогичный фибриногену, не имели успеха; процесс свертывания у иглокожих вероятно связан исключительно с клеточными элементами, к-рые, попадая во внешнюю среду, выпускают псевдоподии, выделяя при этом свертывающееся белковое вещество, а возможно также и способствующий этому процессу фермент (Bottazzi; 1922). Черви (Vermes). В классе червей, весьма неоднородном по своему филогенетическому составу, чрезвычайно сложны и физиол. отношения между входящими в его состав семействами. В частности очень разнообразны и неоднородны в пределах этого класса как самое устройство кровеносной системы и полости тела, так и физиологич. характер наполняющих их жидкостей. У плоских червей устройство кровеносной системы напоминает гастро-васкулярную систему кишечнополостных. У круглых и кольчатых червей наряду с полостью тела имеется незамкнутая кровеносная система, у других кровеносная система вполне замкнута. Замкнутая кровеносная система, содержащая окрашенную в красный цвет жидкость, имеется у многих кольчатых червей за исключением сем. Capitellidae, где обособленной кровеносной системы нет и где К. такая же, как у прочих аннелид, и заполняет обычную полость тела. Красную К. имеют и пьявки (Hirudinea). Имеющиеся у кольчатых червей, в том числе и пьявок, несообщающиеся между собой кровеносные системы и полость тела сильно различаются по характеру содержащейся в них жидкости. В то время как жидкость кровеносной системы окрашена в красный или зеленый цвет содержащимися в ней протеидами, но за редкими исключениями (Nemertini) не содержит эритроцитов, вторая содержит неокрашенную жидкость, в к-рой взвешены эритроциты, сходные с эритроцитами млекопитающих (Quatre-fages; 1850); т. о. в морфо-физиол. отношении содержимое кровеносной системы червей сравнимо с К. моллюсков и членистоногих, в то время как их полостная, или перивисце-ральная жидкость соответствует крови позвоночных (Milne Edwards, 1859; Cuenot,1891); что касается лейкоцитов, то они одинаково встречаются в обеих системах. Надо заметить, что указанные отношения развивались весьма постепенно. Это следует из того, что у нек-рых из родов сем. Terebellidae при наличии окрашенной К. полостная жидкость не содержит эритроцитов; наконец у низших представителей этого же семейства нет эритроцитов в полости тела, но в то же время нет и особой кровеносной системы с окрашенной кровяной жидкостью. Лейкоциты представлены у червей несколькими типами лимфоцитоподобных клеток—слизистыми, жирсодержащими (олеоцитами), ва-куолистыми лимфоцитами (cellules adiposp-heruleuses). В полости тела всех червей плавают еще т. н. хлорагогенные клетки, наполненные секретом зеленого цвета. Эти клетки, вероятно оторвавшиеся от стенки полости тела, несут повидимому выделительные функции. Самые взрослые формы лейкоцитов снабжены б. ч. оксифильной зернистостью (Kollmann; 1908). Встречаются лейкоциты с белковыми, жировыми и желточными включениями, а также с экскреторными зернами. Все это указывает на то, что они принимают участие в вегетативных процессах. Очень характерным лейкоцито-подобным элементом являются у нек-рых червей (Sipunculus, Phascolosoma) так наз. урны (см. выше). Эритроциты червей представляются в виде ядросодержащих сферических образований диаметром 8—24
/г. В толстом слое они сообщают крови киноварный или карминово-красный цвет, в отдельности они имеют цвет в зависимости от вида— желто-зеленый или лимонно-желтый. У всех кольчатых червей химически и спектроскопически обнаружен НЬ, сходный с НЬ позвоночных. Отношение числа лейкоцитов к числу эритроцитов равно приблизительно 1 :100 (Kollmann; 1908).—X ромопроте-иды.1. Наиболее широко распространен НЬ, обусловливающий красный цвет крови и эритроцитов. 2. Хлорокруорин (С
Б60Н
845. .N
143FeS
30
167)—зеленый пигмент, очень близкий к Hb (C
e36H
1025N
164FeS
3O
l81), встречается у многих морских червей, дает две полосы поглощения между
С и D и между D и
Е. 3. Гемэритрин (C
427H
7eiN
135. .FeS
20
153), красный пигмент у Sipunculus (Gephyrea). В свежем растворе имеет розовый цвет, на воздухе буреет. Абсорпцион-ных полос не обнаруживает; гемин из него не получен; Fe содержит (Griffiths; 1892). Свертывание. У червей этот процесс сходен в общем со свертыванием у иглокожих как по недоказанности у них фибриногена, так и потому, что главным моментом и здесь является аглютинация лейкоцитов. Лишь у одной формы (Pliymosoma) образуется объемистый прозрачный сверток, напоминая соотв. процесс у членистоногих. Моллюски. Кровеносная система моллюсков представляет все переходы от примитивной лакунарной системы (Amphineura) до высокоразвитой артериально-венозной системы у головоногих моллюсков (Cephalopoda); не менее разнообразна и К. различных представителей этого класса. Плазма К. представлена у моллюсков жидкостью, содержащей глобулины и окрашенной в синий цвет, изредка бесцветной, реже—красной или иного цвета. В жидкой части К. взвешены лейкоциты (амебоциты, лимфоциты), к-рые как в морфологическом, так и в фнкц. отношениях вполне сходны с амебоцитами других беспозвоночных, служат целям фагоцитоза, экскреции, ассимиляции и накопления запасных веществ. Содержание протеиновых веществ в плазме К. колеблется у различных моллюсков между 1%
0 и 10%
о. В качественном отношении это б. ч. глобулины, из к-рых наиболее существенное значение имеет гемоцианин, протеин голубого цвета, содержащий медь (C
867.H
13fi3. • 0
258N
mS
4Cu); молек. вес 18.762 (Griffiths; 1892); по другим данным его молекулярный вес 16.642 или 21.700. Гемоцианин является дыхательным хромопротеидом, являясь в этом отношении аналогом НЬ. Сравнительный состав гемоцианина и гемоглобина. Составные части Гемоцианин Гемоглобин (Limula) (быка) Меланин ....... Лизин........ AMiiHO-N-фильтраты . Пролин,оксипролин, триптофан ..... 6,25 1,65 0,80 15,73 13,23 8,29 51,30 3,80 5,24 3,6 ? 7,7 12,7 10,9 57 2,9 У нек-рых моллюсков вместо гемоцианина имеется НЬ частью в растворенном состоянии, частью связанный с определенными клетками (Lamellibranchiata). Наконец многие моллюски вообще лишены хромопротеи-дов. Гемоглобин образует при кристаллизации диализирваонного раствора, обработанного (NH
4)
2S0
4, кристаллы оксигемоциа-нина, форма к-рых для разных моллюсков неодинакова. Сходный гемоцианин выделен и от одного ракообразного (Palinurus). Окси-гемоцианин дает ясную полосу поглощения в области линии D (А = 579
Ttifi; Kruken-berg; 1882). В электрометрическом ■ отношении гемоцианин является отрицательным коллоидом. Для кроликов и морских свинок он не ядовит. Иммунизация кроликов гемоцианином приводит к образованию пре- ципитинов. Связь Си в молекуле гемоцианина (содержится в ней в количестве 0,35%) представляется гораздо более лябильной, чем связь железа в НЬ. Содержание 0
2 в гемоцианине: на 100
см3 насыщенного воздухом раствора гемоцианина содержится (из расчета на 1 г Си) в среднем 135
см3 0
2 у моллюсков и 224
см3 у ракообразных (Quagliariello; 1922). Сравнительное изучение гемоцианинов различного происхождения показало, что прямой пропорциональности между содержанием в крови Си и ее способностью связывать О
а не существует. Физиология гемоцианина представляет еще много неясного. В частности недостаточно изучены естественные условия равновесия между оксигемоцианином и 0
2, т. к. прямой опыт показал, что для обесцвечивания крови, т. е. для диссоциации оксигемоцианина при t° 20—25° требуется почти полный вакуум, в то время как при 40—45° диссоциация происходит уже при давлении 250— 300
мм. Так. обр. неясно, как осуществляется диссоциация в организме моллюска при низкой t° его организма. С другой стороны физ.-хим. свойства различных гемоцианинов обнаруживают целый ряд видовых различий. Гемоглобин, встречающийся у нек-рых пластинчатожаберных моллюсков, в общем сходен в НЬ позвоночных, отличаясь впрочем некоторыми физическими и физ. -химич. свойствами. Свойства Planorbis (моллюск) Человек Спектр поглощения . Темп, свертывания . Л=578 И 542 49° А=581 И 545 69° Причина существования у одних моллюсков гемоцианина, а у «других моллюсков, близко к ним стоящих,—гемоглобина совершенно невыяснена. Неокрашенные протеины, встречающиеся в крови нек-рых моллюсков, пови-димому не играют роли в процессе дыхания моллюсков, как предполагали раньше. Ферменты. В крови моллюсков обнаружена пероксидаза, амилаза и зимаза (Bot-tazzi). Свертывание. Кровь моллюсков фибриногена не содержит и к свертыванию не способна. При стоянии вне организма в ней образуются такие же клеточные агломераты, как у иглокожих. Ракообразные (Crustacea). Кровеносная система ракообразных почти целиком замкнута, и К. представляет у них жидкость, богатую протеинами и содержащую ге-моцианин, а также форменные элементы, представленные разнообразными клетками типа лимфоцитов, но различающимися по присутствию, количеству или отсутствию оксифильных зерен. Клетки К. способны к фагоцитозу. Их зернистость связана с ассимиляционной деятельностью, т. к. при голодании животного (экспериментальном или при линьке) зернистость клеток резко падает. Кроме того встречаются клетки с крупными базофильными зернами, которым приписывается функция экскреторная (не-фрофагоциты; Bruntz, 1904). Кровь рако- образных почти всегда бесцветна, прозрачна или слегка замутнена взвешенными в ней клетками. На воздухе она б. ч. синеет, реже становится красной или фиолетовой, как напр. у речного рака. При стоянии начинает издавать запах триметиламина. Удельный вес 1,020—1,030; реакция слабощелочная. Содержание белка очень высокое (до 57а %)• Кровь- свертывается, но настоящий фибриноген отсутствует. Хромопротеи-ды: 1) гемоцианин, количество к-рого сильно колеблется в зависимости от вида, 2) гемоглобин, 3) липохромы, сообщающие крови красно-коричнево-желтый цвет. При одновременном присутствии гемоцианина и липо-хрома К. становится на воздухе фиолетовой. Только первые два хромопротеида несут дыхательную функцию, значение же третьего не выяснено; известно лишь, что он связан с окраской панцыря. Ферменты. В крови ракообразных обнаружены протеа-зы, амилазы, липазы, диастазы, оксидазы, тирозиназы. Повидимому в ней имеются также ферменты, способствующие свертыванию. Ядовитость. Кровь ракообразных не ядовита для морских свинок, кроликов и собак. Лягушка значительно восприимчивее. Наиболее ядовитое действие К. оказывает на других ракообразных. Свертывание К. представляет у ракообразных очень сложный процесс, уже вполне напоминающий свертывание К. у высших животных и впервые в животном мире играющий роль при остановке кровотечения. Он протекает в две фазы: а) сначала происходит аглютинация клеток, б) затем наступает вторичное свертывание плазмы. Аглютинация протекает при явлениях сильного изменения клеток, повидимому выделяющих фибрин-фермент, под влиянием к-рого вокруг этих клеток, являющихся центрами свертывания, и происходит выпадение фибрина. Т. о. можно думать, что процесс свертывания вырабатывается в животном царстве весьма постепенно и что формой, филогенетически наиболее ранней, является аглютинация лейкоцитов. Трахейнодышащие (лат. Trachea-ta— паукообразные + тысяченожки + насекомые). Кровеносная система не замкнута. Дыхательный газообмен происходит через трахеи, вследствие чего кровеносная система за редкими исключениями весьма рудиментарна. Кровь бесцветна или окрашена в желтоватый или зеленоватый цвет. Содержит амебоидные клетки: а) незернистые амебоидные фагоцитирующие лейкоциты, б) зернистые лейкоциты с мелкими оксифильными зернами, в) cellules spheruleuses—клетки с крупными сферическими, слегка базофильными зернами. У насекомых, у к-рых морфология К. изучена лучше, чем у других групп, крупнозернистые клетки суданофильны. Амебоциты насекомых являются энергичными фагоцитами и играют большую роль при явлениях естественного гистолиза, сопровождающего процесс превращения насекомого. В экспериментальных условиях фагоциты насекомых проявляют энергичную деятельность против введенных в полость тела бактерий. Реакция гемолимфы, т. е. жидкой части К., кислая или нейтральная (Ponlton, 1890; Scholte, 1922). Количество крови у насекомых во взрослом состоянии очень невелико; у личинок ее значительно больше. Содержание белка в К. доходит до 10%. При подсушивании К. выпадают кристаллы органических (мочевая к-та, щавелевая к-та, тирозин) и неорганических соединений. Свертывание изучено у насекомых чрезвычайно недостаточно, гл. обр. вследствие невозможности иметь большое количество крови. Окраска крови. Свежая К. совершенно бесцветна либо имеет слабожелтый, зеленоватый или красноватый и даже коричневый цвет. Зеленый цвет К. насекомых вызывается пигментом, весьма близким к хлорофилу. Он происходит из хлорофила пищи и присутствует в К. в виде растворенного метахлоро-фила (Poulton, 1890; Geyer, 1913), давая характерную полосу поглощения Брюстера (Brewster) в красной части спектра. В некоторых случаях зеленый цвет К. не имеет ничего общего с хлорофилом и появляется в результате действия тирозиназы. Кроме того в К. насекомых содержится целый ряд липо-хромов (зоонэритрин, зооксантин и т. д.).
\<> Ц в е т к р о в и и п о л. Исследование К. гусениц и куколок показало, что во многих случаях цвет К. характерен для определен. пола; так, у самцов она окрашена в желтый цвет, у самок—в зеленый (Geyer; 1913). С возрастом эти различия ослабевают, и К. самок постепенно желтеет. Указанная особенность встречается не только у насекомых, питающихся зелеными растениями (Eepidoptera), но в виде исключения и у нек-рых хищных насекомых, напр. у стрекоз. Исключения встречаются однако и в первой группе. Поскольку зеленая окраска у самок вызвана присутствием метахлорофила, а желтая самцов—присутствием близкого ему ксанто-фила, можно думать, что эта разница вызвана различиями в обмене 9 и
d, к-рые связаны с физиод. особенностями клеток кишечника у обоих полов. Возможно, что при этом играет роль и секреция половых желез (Geyer; 1913). Повидимому окраска К., так же как и разных тканей и органов, может мутировать; так, бабочка Со lias phylodyce, образующая нормально яркозеленых гусениц, дает в результате мутации гусениц сине-зеленого цвета. Причина изменения имеет вторичный характер и связана не с геном окраски (Gerould; 1921), а с тем, что поглощаемый с пищей ксантофил в кишечнике начинает разлагатьсяи перестает поступать в кровь. Имеется наблюдение, что б. ч. К. самок редуцирует органические краски сильней, чем К. самцов (Dewitz; 1912).— Ферменты. В крови насекомых большую роль играют окислительные ферменты (тирозиназа). Их действие сказывается в том, что при стоянии гемолимфы на воздухе из нее выпадает чернеющий осадок (явление меланоза) (Krukenberg, 1886 ;Ffedericq, 1896). У нек-рых насекомых найдены диастазы и глюкозидазы. Кроме того в ней присутствует каталаза, реже—пероксидаза. По данным Бателли и Штерн в биологии насекомых большую роль играют растворимые в воде оксид азы, в то время как нерастворимые в воде оксидоны, лежащие в основе тканевого дыхания позвоночных, не играют у насеко- мых никакой роли (Battelli u. Stern; 1913) У нек-рых насекомых К. играет роль защитного приспособления. В этих случаях (напр. у Coccinella, Meloe, Lytta vesicatoria) из отверстия, лежащего в сочленении бедра и голени, с силой выбрасывается ядовитая жидкость, содержащая кантаридин и действующая как средство защиты. Эта жидкость несомненно соответствует крови. В других случаях, когда жидкость выбрасывается через ротовое или анальное отверстие^ это вероятно не К., а продукт клеточной секреции специальных желез. Оболочники (Tunicata) представляют особый интерес, являясь, как полагают, формой, филогенетически наиболее близкой к позвоночным. Кровеносная система их сравнительно проста и незамкнута. К. состоит из жидкой плазмы, в которой взвешены многочисленные морфолог, элементы. Последние представлены 1) типичными амебоцитами с мельчайшей зернистостью, 2) амебоцитами с жировыми включениями, 3)' амебоцитами с крупными вакуолями, 4) амебоцитами с оранжевыми включениями (Cuenot; 1899). Амебоциты оболочников несут фагоцитарные и пищеварительные функции, являясь повидимому местами отложения запасных веществ. — Свойства плазмы. Плазма свежевыпущенной крови прозрачна, бесцветна, имеет нейтральную реакцию в отличие от резко кислотного осадка. Свертывания К. не наблюдается, однако и тут происходит аглютинация форменных элементов. При стоянии на воздухе плазма быстро синеет, что связано с присутствием в ней клеточных элементов, а именно —- лейкоцитов, напоминающих по форме тутовую ягоду; эти клетки дают резкое и быстрое почернение с Os0
4. Реакция этих клеток резко кислая, вследствие чего получается тёмнокрасное окрашивание под влиянием Methylrot в отличие от желтого окрашивания жидкой плазмы. Вытяжка из этих клеток в дестилированнои воде дает резкое окрашивание в черно-бурый цвет, к-рое наступает не только в присутствии 0
2, но также в атмосфере Н и С0
2, и стало быть не является простой реакцией окисления. Путем фильтрования побуревшей жидкости получается прозрачная кислая жидкость, к-рая медленно синеет. Осаждение ацетоном позволяет выделить из нее белковый хромоген , к-рый отличается высоким содержанием (от 8% до 10%) ванадиевой K-Tbi(Henze; 1911— 1913). Посинение бесцветного хромогена основано на его окислении. Медленное же наступление посинения объясняется кислой реакцией среды, т. к. в подщелоченной среде окисление происходит мгновенно. В виду того что в К. оболочников (Phallusia) не удается обнаружить присутствия лябильно связанного 0
2, следует думать, что ванадиевый хромоген играет роль катализатора, самоокислению к-рого и препятствует высокое содержание S0
3 в ванадиевых клетках, достигающее там 6% (в 20 раз больше, чем в морской воде). Механизм действия хромогена состоит повидимому в том, что, являясь катализатором, он способствует простой абсорпции 0
2, растворенного в воде, протекающей через жабры. Содержание белка в плазме доходит до 3%. Гваяковая проба на оксидазу положительна.
Г. Этптейн. III. Сравнительная морфология К. Сравнительную морфологию К. можно понимать и более широко, имея в виду весь животный мир вообще, и более узко, рассматривая ее только в рамках позвоночных. Вопрос о сравнительной морфологии крови у последних разработан более детально. В сравнительном очерке нельзя отделять К. от соединительной ткани, вместе с которой она представляет внутреннюю среду организма. Между К. и соединительной тканью происходит постоянный обмен как клеточными элементами, так и жидкими составными частями (плазма К., тканевая жидкость). Все функции К. без исключения присущи в большей или меньшей степени также и соединительной ткани. Различные функции при этом оказываются то разделенными между специально диференцированными элементами то объединенными в тех или иных комбинациях в элементах менее специализированных. Установить здесь какие-либо закономерности, стоящие в связи с общей эволюцией животного мира, так же не представляется возможным, как и для других гист. элементов. В отношении степени общей диференцировки тканей внутренней среды— всех животных можно разделить на следующие группы: 1) животные, лишенные К. и полостной жидкости; 2) животные с полостной жидкостью и кровеносными сосудами, сообщающимися и с полостной жидкостью и с тканевыми лакунами, и 3) животные с отделенной замкнутой сосудистой системой, не стоящей в сообщении ни с полостями тела ни с тканевой жидкостью. Первую группу составляют губки, кишечнополостные и плоские черви; вторую—все членистоногие, большинство моллюсков, иглокожие и нек-рые другие; третья группа представлена гл. обр. кольчатыми червями, нек-рыми моллюсками (головоногие) и позвоночными. У губок и плоских червей мезенхима, или промежуточная ткань, развита мощно, у кишечнополостных—менее значительно. У плоских червей элементы мезенхимы мало диференцированы и представлены оседлыми клетками. Говорить здесь о настоящих свободных подвижных клетках не приходится (М. Prenant). У губок (Мечников, Кольман) имеются уже амебоидные подвижные клетки (амебоциты), может быть даже двух родов. Эти клетки способны к фагоцитозу, затем они транспортируют накапливающиеся в их протоплазме вещества из одного места в другое, и наконец они же принимают участие в образовании скелетных частей (известковых и кремневых игол и спонгиновых перекладин). У гидроидных полипов в промежуточной пластинке также обнаружены блуждающие клетки, содержащие в своей протоплазме характерную для лейкоцитов зернистость.—У животных второй группы имеется и полостная жидкость и сосудистая система, представленная однако только ббльшим или меньшим числом главных стволов, из к-рых К. растекается по лакунам и щелям интерстициальной соединительной ткани и отсюда сообщается и с полостной жидкостью. Т. о. у животных этой группы не наблюдается значительной разницы в составе полостной и тканевой жидкости и К. Наоборот, у животных третьей группы, т. е. главным образом у кольчатых червей, нек-рых моллюсков и у всех позвоночных, полостная жидкость и соединительная ткань всюду отделены сосудистой стенкой от циркулирующей по сосудам К. Поэтому у этих форм морфол. состав сосудистой К. отличен от полостных и соединительнотканных элементов. У всех беспозвоночных (за исключением м. б. одних морских звезд) имеются две основные формы подвижных кровяных элементов или, как их иногда называют, цельамебоцитов. Одни не содержат зерен в б. или м. базофильной протоплазме, обладают б.ч.круглым ядром и имеют различные размеры (от 5 до 15
[л). Это базо-фильные не зернистые амебоциты (рис. 1—3). Другие—зернистые амебоцит ы—имеют большие размеры (до 20
fj) и специфическую, в большинстве случаев окси-или амфофильную зернистость; ядро наиболее крупных из них у многих животных бывает полиморфным. У животных с замкнутой кровеносной системой (аннелиды) в сосудистой К. циркулируют амебоциты, несколько отличные от полостных, к-рым некоторые авторы (напр. Lison) дают название гем-амебоцитов. Однако есть все основания считать гемамебоциты формами, идентичными с мелкими незернистыми полостными (и тканевыми) амебоцитами (Заварзин). Наиболее мелкие незернистые амебоциты отличаются более базофильной протоплазмой (рис. 1—3) и являются формами наименее диференцированными и наименее специализированными (Kollmann, Romieu, Заварзин, Лазаренко). Обычно из них образуются все остальные клеточные элементы как крови, так и соединительной ткани (рис. 2). Они могут давать начало более крупным незернистым амебоцитам, которые вместе с тем являются наиболее активными фагоцитами (рис. 1—3). С другой стороны из них же происходят и зернистые амебоциты путем накопления в утрачивающей свои базофильные свойства протоплазме специфической зернистости. Зернистые амебоциты гораздо менее активны в смысле фагоцитоза, но их количество значительно возрастает в случае попадания в организм бактерий; т. о. рядом свойств они напоминают специфические лейкоциты позвоночных. Из базофильных амебоцитов возникают и экскреторные клетки, накопляющие в протоплазме ураты [например у моллюсков (Заварзин)], и оседлые клетки резервного характера [например Лангеровы клетки моллюсков, наполненные гликогеном (Заварзин)]. Зернистые амебоциты часто преобразуются в резервные клетки смешанного белкового и жирового характера, то свободные [т. н. элеоциты (рис. За) аннелид (Romieu)] то оседлые [клетки жирового тела насекомых (Лазаренко)]. В обоих этих случаях возможно совмещение резервной и экскреторной функций, потому что как в элео-цитах, так и в жировом теле имеются и ураты. Особый интерес представляют базофильные амебоциты как участники регенеративных процессов, происходящих в соедини-
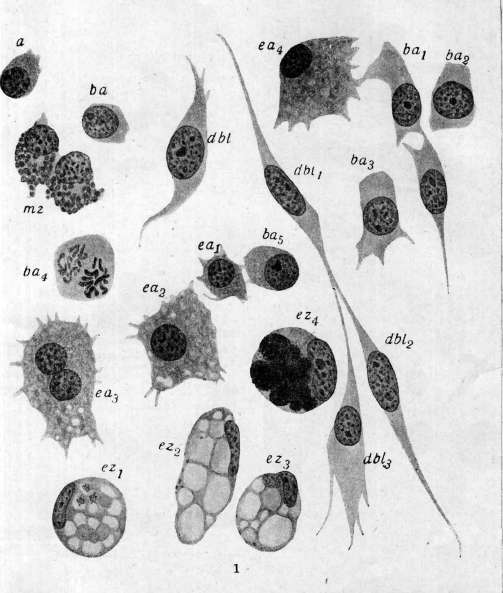
Рисунок 1. Клеточные элементы крови и соединительной ткани моллюска беззубки: а,Ьа—Ьсц—незернистые ба-зофильные амебоциты (Ьа, — митоз); dbl,dblY — dbl3 — превращение их в десмобластов (соединительнотканные клетки); e^—eat—эозинофильные (зернистые) амебоциты; ez1—ezl—экскреторные клетки; тг—межмышечные зернистые тканевые клетки (cellules spheruleuses Кольмана). (По Заварзину.)
Рисунок 2а. Клеточные формы крови личинки жука-носОрога:
а—мелкая недиференцированная форма из кроветворного органа;
Ь,с—незернистые амебоциты;
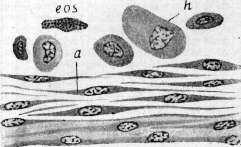
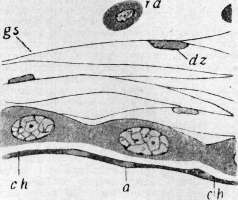
d,e—«круглые клетки» (зернистые амебоциты); /— эозинофилы. Рисунок 2b—d. Образование соединительнотканной капсулы вокруг инородного тела у жука-носорога (три последовательных стадия):
a,db,dz—незернистые амебоциты, превращающиеся в основное вещество (0s);
h,га—«круглые клетки»;
eos—эозинофил;
ch—хитин. (По Лаваренко.) Рисунок 3.
а,Ь—эритроциты (Ь—в профиль) аннелиды Pista cristata в свежем виде (темные капли—жир); cd— незернистые амебоциты той же аннелиды; е,/—зернистые амебоциты Perinereis cultrifera. Рисунок За. Элеоцит Amphitrite rubra (светлые капли—жир; темные крупные зерна—экскреторные гранулы) (По Ромье.) (Рисунок 2а—d, 3 и За см. на след. вкладной таблице.)
2b
2d
f
e 
Щ § •
3a 2c К ст.
Кровь. КРОВЬ
630 тельной ткани. При некоторых экспериментальных условиях и в частности при попадании инородного тела в полость животного или в соединительную ткань вокруг этого инородного тела образуется соединительнотканная капсула. Образование такой капсулы идет целиком (рис. 2Ь—а) за счет базо-фильных амебоцитов, к-рые распластываются на поверхности инородного тела (явление т. н. тигмоцитоза), сливаются в синцитий и путем диференцировки протоплазмы дают начало образованию основного вещества. Сосудистая стенка у беспозвоночных то имеет эндотелий то нет. Есть указания, что как эндотелий, так и сама сосудистая стенка образуются из тех же амебоцитов (Дани-ни). Очень характерно, что где нет оседлых клеток в соединительной ткани (напр. у насекомых), там и сосуды не имеют эндотелия. У многих беспозвоночных в К. имеются дыхательные пигменты. Чаще всего—это содержащие железо гемоглобин, гемэритрин (красно-желтые), хлорокруорин (зеленый) и содержащий медь гемоцианин (синий). Вопрос о бесцветном пигменте ахроглобике остается открытым и решается скорей отрицательно. В случаях бесцветной К. пигмент либо отсутствует вообще либо представлен очень слабыми концентрациями гемоцианина. Пигменты либо растворены в кровяной плазме (многие аннелиды, в частности дождевой червь, некоторые моллюски и другие) либо концентрируются в особых специализированных клетках, называемых по аналогии с позвоночными эритроцитами (рис. 3). Эритроциты у беспозвоночных встречаются как в сосудистой К., так и в полости, жидкости. Иногда они присутствуют только в полостной лимфе и отсутствуют в К., реже бывает наоборот. Эритроциты известны у немертин, аннелид, гефирей и моллюсков. Распространение их носит случайный характер. Иногда из двух рядом стоящих видов [напр. моллюски Solen legumen (Грисбах) и Solen vagina, аннелиды Polycirrus haematodes и Polycirrus caliendrum (Romieu)] один имеет эритроциты, другой не имеет. Эритроциты в большинстве случаев ядерные, имеют не особенно постоянные размеры, но постоянную, обычно округлую или овальную форму. К амебоидным движениям не способны. Протоплазма их наполнена пигментом (гемоглобином или гемэритрином) и часто содержит в виде включений ураты и жир. Таким образом эритроциты беспозвоночных могут сочетать в себе еще и резервную и экскреторную функции. Очень редко (единственный случай—аннелида Magelona) эритроциты бывают и безъядерные, такие же как и у млекопитающих. Эти эритроциты включений не содержат и встречаются только в сосудистой К. (Romieu). Родоначальной формой для всех перечисленных элементов до эритроцитов включительно является мелкий незернистый базофильный амебоцит, который, размножаясь митозом, диференци-руется в различных направлениях (рис. 1 и 2а). Митозы встречаются, хотя и более редко, и в зернистых амебоцитах. Специализированные клетки (эритроциты, элеоциты, экскреторные клетки, соединительнотканные клетки и т. д.) обычно уже не размно- жаются и постепенно Дегенерируют. Размножение происходит в ткани, в крови и в полостной лимфе. Вопрос о существовании специальных кроветворных органов у беспозвоночных остается в значительной степени открытым и в большинстве случаев решается отрицательно. Лимфоидные органы описаны у головоногих, насекомых, десятиногих раков. Описывались и спонтанные очаги кроветворения, рассеянные в соединительной ткани (речной рак, насекомые). Настоящие лимфоидные органы состоят из соединительнотканной сетчатой стромы, в петлях к-рой располагаются размножающиеся митозом мелкие базофильные незернистые амебоциты. Диференцировка продуктов их размножения совершается всегда вне лимфоидных органов и вероятно гетеропластическим путем. У многих беспозвоночных (например артроподы, моллюски и т. д.) существуют специальные фагоцитарные органы, похожие на лимфоидные, но содержащие в своей строме только экскреторно-фагоцитарные клетки (нефрофа-гоциты), происходящие также из незерни-■стых амебоцитов (см. выше).—У позвоночных кровь отделена от соединительной ткани и функционально и морфологически гораздо более резко, чем у беспозвоночных (с аннелидами включительно). В связи с этим клеточные элементы как К., так и соединительной ткани являются более диферен-цированными. В то время как у беспозвоночных обычно имеются только два основных типа амебоцитов, у большинства позвоночных их (лейкоцитов) бывает не менее трех; в этом отношении к позвоночным приближаются одни лишь насекомые, имеющие амебоциты трех видов. Кроме эритроцитов в сосудистой К. позвоночных различают незернистые лейкоциты (лимфоциты, моноциты) и зернистые лейкоциты, или грануло-циты (эозинофилы, специальные лейкоциты, базофильные лейкоциты).—Яснее всего дело обстоит с эритроцитами. В кровяной плазме у позвоночных НЬ никогда не бывает. Точно так же не встречаются и другие дыхательные пигменты. Эритроциты низших позвоночных имеют ядра, у взрослых млекопитающих они безъядерные. У каждого данного вида эритроциты отличаются гораздо большим, чем у беспозвоночных, постоянством размеров. Наиболее крупные эритроциты имеются у амфибий и рептилий, наиболее мелкие—у птиц и млекопитающих. Форма овальная у большинства ядерных эритроцитов (из безъядерных у ламы и верблюда) и круглая у эритроцитов большинства млекопитающих и у нек-рых рыб.—Другим неподвижным специализированным элементом крови позвоночных являются тромбоциты низших позвоночных и кровяные пластинки млекопитающих. Тромбоциты представляют собой мелкие ядерные клетки, несколько похожие на эритроциты, но лишенные НЬ; морфол. значение безъядерных кровяных пластинок остается совершенно невыясненным. —Лейкоциты позвоночных большинством авторов подразделяются на две большие группы: зернистые и незернистые. Эти названия справедливы гл. обр. только для человека и млекопи- тающих, причем у некоторых позвоночных лейкоциты, относящиеся к группе зернистых, специфической зернистости в протоплазме не содержат (напр. у многих рыб). Зернистые лейкоциты являются специализированными, неспособными к размножению формами. У животных с наиболее диферен-цированными кровяными элементами (птицы, млекопитающие) различают три вида гранулоцитов: специальные, базофильные и эозинофильные. В подавляющем большинстве обычно встречаются специальные лейкоциты. Эти лейкоциты то обладают специфической зернистостью (млекопитающие, птицы, рептилии, амфибии, нек-рые рыбы) то лишены ее (некоторые рыбы). Сама зернистость у различных видов крайне разнообразна: она то нейтрофильная и мелкая (собака, человек, лягушка) то ацидофильная и крупная (птицы, рептилии, кролик). Особенно разнообразны специальные лейкоциты у рыб. Эозинофильные гранулоциты представляют более постоянную форму и имеются почти у всех позвоночных [за исключением многих рыб, у к-рых зато часто имеются лейкоциты с крупными белковыми включениями, напоминающими белковые клетки рака и др. подобные формы (см. выше)].— Эозино-ф и л ы обычно немногочисленны (2—5 % общего числа лейкоцитов), но у рептилий (у змей) их, наоборот, очень много. Эозино-филы отличаются более постоянным характером зернистости; она всегда резко ацидофильная и более крупная, чем у специальных лейкоцитов.-—Менее определенной клеточной формой являются базофильные, или тучные лейкоциты. У рыб они по-видимому, за очень редкими исключениями, вообще отсутствуют. Кроме того базофилы млекопитающих сильно отличаются от базо-филов птиц, рептилий и особенно амфибий. В то время как базофильные лейкоциты млекопитающих (составляют около 1% общего числа) довольно резко отличаются от т. н. тучных клеток соединительной ткани, базофилы птиц, рептилий, а особенно амфибий имеют другой характер. Кровяные базофилы амфибий не могут быть резко отграничены от тучных клеток соединительн. ткани (Максимов), а базофилы рептилий и птиц м. б. являются незрелыми миелоидными элементами (Kleineberger и Walter). Во всяком случае под именем базофилов у различных позвоночных описываются не однозначные формы. Лимфоциты низших позвоночных (рыб, амфибий, может быть птиц и рептилий) представляют собой клетки в 7 — 10
fi величиной с узким ободком базофиль-ной незернистой протоплазмы и с круглым ядром. Они являются безусловно неди-ференцированными элементами, могущими гетеропластическим путем переходить в различные специализированные формы. В последнее время (Максимов) называют их даже гемоцитобластами (см. ниже), а не лимфоцитами. Эти лимфоциты могут возникать из ретикулярных клеток и сами путем увеличения плазматического ободка давать начало моноцитам и макрофагам. Есть указания (Алфеева, И. Крафт), что из этих лимфоцитов могут возникать и фибробласты. Т. о. лим- фоциты низших позвоночных по своим потенциям очень похожи на базофильные незернистые амебоциты беспозвоночных. В К. они всегда находятся в относительно значительном количестве. У высших форм и гл. обр. у млекопитающих среди лимфоцитов можно различать две формы: одну, сосредоточенную гл. обр. в кроветворных органах, называемую большим лимфоцитом (лимфобластом, гемоцитобластом), и другую, образующуюся в лимф, узлах и присутствующую в значительном числе в К., называемую малым лимфоцитом. У большинства млекопитающих (человек, собака, лошадь) лимфоцитов в К. меньше (около 20%), чем гранулоцитов, но у нек-рых животных (кролик и др.) они находятся в преобладающем (около 60%) большинстве.— Вопрос о моноцитах еще более сложен потому, что в наст, время следует считать доказанным, что часть моноцитов может иметь соединительнотканное гистиогенное происхождение и представлять собой округлившиеся и попавшие в кровяное русло ретикулярные и эндотелиальные клетки и гистиоциты рыхлой соединительн. ткани. Т. о. моноциты могут иметь и гистиогенное происхождение и гематогенное (из большого лимфоцита). Во всяком случае моноциты являются формами мало специализированными, обладающими значительной нефрофагоци-тарной способностью (макрофаги).—У низших позвоночных (гл. обр. у рыб, отчасти у амфибий) все кровяные элементы менее специализированы; кроме того в этих группах встречаются элементы, отсутствующие у других позвоночных. Кроме упомянутых выше белковых клеток рыб здесь имеются иногда пигментные лейкоциты. Кроме того в лейкоцитах рыб иногда встречаются экскреторные включения. Все это сближает К. рыб с К. беспозвоночных. Кроветворение изучено гл. образом у млекопитающих (Максимов) и амфибий (Држевина, Максимов) и хуже у птиц (Дан-чакова, Мясоедов). В отношении кроветворения позвоночные представляют достаточно пеструю картину. Главное отличие от беспозвоночных состоит в том, что в то время как у большинства последних размножение клеточных элементов совершается в самой кровяной (полостной) жидкости, у позвоночных кроветворение внесено в соединительную ткань, в кроветворные органы, и в К. поступают обычно только зрелые формы, за исключением может быть нек-рых рыб и рептилий, у к-рых возможно размножение и диференцировка клеточных элементов и В СОСУДИСТОЙ крови.
А. Заварзин.
IV. Сравнительные данные о крови позвоночных. Общее количество крови. Наиболее точные результаты дает метод прямого определения Велькера (Welcker; 1854) в модификациях Мюллера и Абдергальдена (АЬ-derhalden, 1899, 1902; Mtiller, 1901, 1921). В виду того что этот метод, основанный на определении количества НЬ, дает его суммарное количество не только в крови, но также в мышцах и в других органах, он не вполне точен и дает ошибки до 8% (коли- чество Hb в мышцах равно около 5 % общего его количества). Непрямые методы путем введения в К. изотонических растворов соли, декстрина, красок, антитоксинов и т. д., а также определение по образованиюНЬ—СО, дают более точные, но тоже не абсолютные результаты, тем более что получаемые цифры подвержены сильным индивидуальным колебаниям. Представление об общем количестве К. у позвоночных дают следующие цифры. Собака весом 10.350
г содержит крови 7,98—8,25% своего веса; для собаки весом 5.780
г соответствующие цифры равны 8,02—■ 9,00%. Отношение веса К. к весу тела имеет для нек-рых животных следующие значения: минога — 5,2%, окунь — 3,0%, лягушка — 5,7%, голубь — 9,2%, мышь — 7,6%, кролик— 5,5%, коза — 6,2%, кошка—-6,6%, собака — 7,4%. Для отдельн. классов соотв. цифры таковы: рыбы — 2,0%, амфибии— 4,8%, рептилии—5,8%, птицы—8,2%, млекопитающие и человек—6,8% (Велькер). Все определения этого рода имеют весьма относительное значение, и колебания в пределах одного вида очень велики. Так, при прямом определении общего количества К. у 52 кроликов получились следующие цифры. Средний вес тепа 535 1.078 1.971 Проц. отношение веса К. 5,65 5,20 4,49 4,35 Средний вес тела 2.250 2.494 3.147 Проц. отношение веса К. 4,42 4,47 4,70 Попытки вывести общие правила, исходя из поверхности или объема исследуемых животных (Dreyer; 1913), не привели к определенным результатам. Не ясна также зависимость различий от биол. свойств изучаемых объектов—их тепло- или холоднокровности, их растительноядности или плотоядности. Вопрос усложняется еще тем, что не во всех случаях возможно учесть взаимоотношения К. и лимфы. Хим. данные. При исследовании хим. состава одной кровяной сыворотки оказалось, что различия в пределах класса млекопитающих невелики, но что они очень велики при исследовании цельной К., что указывает на существование соотвзтствующих различий в составе эритроцитов. Так, по содержанию Na
20, P
aO
s и К
20 группы I (человек, свинья, лошадь, кролик), II (бык, коза, овца) и III (кошка и собака) относятся, как 1:5:10. Эритроциты лошади, свиньи и кролика вообще не содержат Na, но зато богаты К (4,489—5,250°/
Оо); у прочих млекопитающих количество Na относительно велико (бык 2,281°/оо)> а количество К относительно мало (0,720°/
оо). Очень велики различия в количестве Р между птицами и млекопитающими (курица — 7,510°/
оо, человек— 1,870°/
оо). Отношение между количеством эритроцитов и сывороткой: чело-век-^434,2:565,8; свинья—436,0 :564,0; собака—561,6:438,2; кошка —432,4:568,6; лошадь—391,6:608,4; курица—391,5 :608,5; при этом К. всеядных и плотоядных богаче эритроцитами (466,1°/
00), чем К. травоядных (363,4%о); птицы занимают в этом отношении промежуточное положение (429,7°/
00). Количество твердых частей и воды в К. зависит от соотношения количества сыворотки и эритроцитов. У млекопитающих сухой остаток равен от 214,1°/
00 (всеядные и плотоядные) до 194,4%
0 (травоядные); у птиц он равен 204,1%
о; у рыб—127,0°/оо» У лягушек Ю%•—Количество (относительное) гемоглобина у разных классов: млекопитающие—100; птицы—83,4; рептилии—46,2; амфибии—41,5; рыбы—38,1 (Korniloff; 1876). Количественные данные: на 1.000 вес. частей К. содержится железа, гемоглобина и гематина: человек: 0,545—129,7—6,18; собака: 0,550—139,8—6,24; кошка: 0,457— 122,3—5,18; свинья: 0,525—134,1—5,96; лошадь: 0,492—126,4—5,58; кролик: 0,430— 123,5—4,88; курица: 0,466—102,4^,93; лягушка: 0,425—101,2-^1,82 (Ргеуег; 1871). В общем К. млекопитающих богаче НЬ, чем К. птиц, но при этом птицы (122Д°/
00) занимают среднее положение между все- и плотоядными (152°/
00) с одной стороны и травоядными (116%
0)—с другой. Если принять среднее содержание НЬ в крови млекопитающих за 100, то окажется, что для все- и плотоядных оно будет равно 117,0, для травоядных—89,6 (для нежвачных— 94,7, для жвачных—86,2), для птиц—94,3. Зависимость содержания НЬ от пола у животных в общем такая же, как у человека. Так, в 1.000 ч. К. содержится НЬ у самцов и самок: у человека—125,5—109,4; свиньи— 166,8—154,0; собаки—138,3—146,5; кролика—121,2—116,0; быка—112,0—104,0; курицы—122,6—91,6. Хим. состав плазмы и сыворотки. Поскольку количество фибрина, соотв. фибриногена, в плазме равно 0,5—1% всей массы плазмы, можно считать, что состав сыворотки и плазмы почти одинаков. Процентное содержание в крови воды и твердых частей в разных классах позвоночных таково: у млекопитающих—911 и 89, у птиц— 934 и 66; у рыб (за исключением угря)—также 934 и 66. Влияние пола на содержание воды: мужчины—903, женщины—906, быки—903, коровы—910; коты—909, кошки— 912. Содержание минеральных солей в сыворотке в общем у птиц значительно выше, чем у млекопитающих, превышая его на 12,5%, за исключением Na, количество к-рого у птиц ниже, чем у млекопитающих. Возможно, что более высокое содержание Са у птиц стоит в связи с выработкой известковой скорлупы. Белок содержится в плазме, resp. в сыворотке, в количзствз до 75% сухого остатка. В отношении качественного состава белков отмечаются существенные различия между различными животными. Так, сыворотка теплокровных содержит все 3 рода серумальбуминов
(а, р, у с соответ-ствущими точками свертывания: 70—-73°, 76—80° и 82—85°) за исключением лошади, быка и овцы, у к-рых а-альбумин отсутствует и у к-рых свертывание наступает лишь при 76—80°. У холоднокровных присутствует б. ч. только а-альбумин за исключением угря, у к-рого имеется также и ^-альбумин, и акулы (ScyIlium catulus), у к-рой имеется только jS-альбумин.—Гл обулины. 1. Фибриноген, свертывающийся при 56°, одинаков у всех животных. Количество фибриногена в крови на 1.000 ч. плазмы равно: у человека—4,2,у овцы—6,0,у собаки—4,6, у лошади—4,5, у свиньи—6,5 (Trendelenburg, Loewy; 1924). Среднее количество фибриногена на 1.000 ч. цельной К. равно: у человека—2,1, у свиньи—3,60, у собаки—-1,78, у кошки—2,03, у лошади—2,85, у кролика—3,75, у рогатого скота—6,03, у овцы— 3,80, у курицы—5,85. У холоднокровных количество фибриногена очень мало (Nasse; 1842). Количество фибриногена на 1.000 ч. плазмы: у человека—3,85, собаки—3,09, кошки—3,59, свиньи—6,38, лошади—5,55, кролика—5,97, овцы—5,13, быка—9,95, курицы—6,61. Плазма человека и плотоядных значительно беднее фибрином, чем плазма травоядных и свиньи. В первой группе max. = = 3,85% (человек), во второй—min.=5,13% (коза). У самцов содержание фибрина выше, чем у самок. Содержаниемочевины нами п окисло т. Животное Содержание фибрина в 1.000 ч. плазмы С? Кошка........ 4,39 17,92 4,10 4,55—5,09 3,49 8,21 3,29 4,31—3,51 2. Серумглобулин (параглобулин) содержится у холоднокровных и теплокровных в одинаковом количестве. Соотношение проц. содержания альбуминов и глобулинов в сыворотке разных животных таково: Белок Теплокровное животное Холоднокровное животное Разница Общ. кол. белка Альбумин .... Глобулин .... 6,51 3,61 2,90 3,74 1,12 2,62 2,77 2,49 0,28 Зависимость содержания глобулинов и альбуминов от физиол. состояния: Кролики Нормальные . . . Голодавш. (5 дн.) Белок в сыворотке в % 6,70 7,70 (А) альбумин (G)глобулин 4,80 6,40 1,90 1,30 2,52 4,92 Т. о. у кроликов отношение между альбуминами и глобулинами увеличилось вдвое в результате 5-дневного голода, у лошади же достаточно было 24-часового голодания, чтобы получить превышение эффекта в 2,25 раза. Содержание несверты-вающихся N-веществ. Содержание остаточного N (средние цифры по Бангу). Животное Остаточный N в крови В плазме (в
мг %) Свинья ........ Лошадь....... Овца......... 27 23 35 35 22 19 26 37 26 17 30 36 15 14 . 20 29 О бщее "со- (а) Мочевина (Ь) Ами- Животные держание ноки-
alb остаточн-N слоты Млекопитающие (среднее) .... 30,6 15,3 1,0 Человек .... 6,0 3,5 Свинья. . . . „ 0,9 Собака ..... 1,4 Кошка..... 0,9 Лошадь .... 0,7 1,4 0,9 Кролик .... 0,9 Птицы (среднее) 42,9 8,5 33,5 0,25 Курица .... 33,0 0,4 Голубь ..... 0,1 Рыбы: Акула ..... 4,0 Карп...... 0,4 По содержанию мочевины в К. разные животные распределяются так: млекопитающие 0,00328%, птицы 0,0182%, костистые рыбы 0,0238%, акуловые рыбы 1,8042%. Точно такое же исключительное положение занимают акуловые рыбы и в отношении экстрактивных веществ. Животные Млекопитающие (кроме человека) ..... Человек ....... Свинья ........ Собака ........ Лошадь ....... Бык......... Овца......... Птицы: Курица ....... Рыбы: Акула ........ Костистые морские . » пресноводные Креа-тинин Креатин 4,94 6,80 5,31 3,12 5,14 5,95 3,34 3,74 36,0 6,20 5,46 Мочевая к-та 2,0
о о о о о 1,67 4,22 ? Т. о. кровь птиц несравненно богаче мочевой к-той, чем К. млекопитающих, что стоит в связи с тем, что у первых и моча содержит гл. обр. мочевую кислоту. Содержание аминокислот в крови у разных животных. N аминоки- Животные Человек слот 7,13 Свинья . 8,43—10,90 Собака . 4,60—10.20 Кошка . 8,68 Бык . . 6,58 Овца . . 7,0 Животные Кролик . Курица . Акула . . Костистые рыбы . . N аминокислот 9,20 20,29 39,0 28,0 Содержание в крови NH
3 (в
мг%). Млекопитающие...............
о,зо Птицы.....................
0,38 Рыбы: Акулы.....................
2,23 Ганоиды (пресноводные)...........
1,55 Костистые морские..............
3,94 »
пресноводные...........
1,47 Аллантоин в крови человека отсутствует; в К. быка и свиньи имеется 0,78, соответственно 0,57
мг%, что отвечает присутствию этого соединения и в моче у последних. Сахар и редуцирующие вещества содержатся у разных животных в следующих количествах: у млекопитающих—81
мг%, у птиц— 201
мг%, у амфибий—65
мг%, у рыб—
50 мг%. В пределах одного и того же вида колебания доходят до 100%. Так, для собак найдены цифры от 79 до 162, но при этом необходимо принять во внимание явления эмоциональной гипергликемии у лабораторных животных, наступающей под влиянием привязывания, испуга и т. д. (Cannon; 1911). Среди млекопитающих наиболее низкие цифры сахара в К. найдены у холоднокровных и жвачных (50—57
мг%), у нежвачных эта цифра доходит до 90
мг%. Жиры, липоиды, холестерин (содержа- ние в крови в
мг %). Ней- Жир- Холе- Леци- Животные тральн. ные стерин тин жиры к-ты Человек . . 62—78 1R0 Свинья . . Собака . . . Кошка. . . Лошадь . . Кролик . . Нейтральный жир содержится только в плазме, но не в эритроцитах. Жирные к-ты и холестерин распределяются между ними приблизительно равномерно. Содержание лецитина в эритроцитах выше, чем в плазме. Пигменты. Окраска плазмы или сыворотки б. или м. характерна для разных видов. У лошади она лимонно- или золотисто-желтая; у быка—красно-желтая; у кролика и свиньи—почти бесцветная. Цвет плазмы обусловливается присутствием в ней пигментов: липохромов или лютеинов и желчных пигментов, особенно билирубина. Липохро-мы животных—каротиноиды—близки к растительным липохромам: растворимому в спирте ксантофилу (C
40H
seO
2) и растворимому в эфире каротину (С4оН
5в) (Willstatter, Escher; 1910). Полное или почти полное отсутствие липохромов характеризует свинью, собаку, козу, кролика и мор'скую свинку. Большое содержание липохромов характерно для человека, быка, кур, голубей. Обыкновенно присутствует либо тот либо другой пигмент; но если присутствуют оба, то один обычно сильно преобладает. Так, у человека и у быка преобладает каротин, у курицы— ксантофил. Каротин встречается также у лошади; но его совершенно или почти не имеется у овцы или козы. Количество липохромов колеблется в пределах отдельных видов весьма широко и зависит от содержания липохромов в пище; но при этом выяснилось, что каждый данный вид животного характеризуется способностью пропускать из кишечника в кровь лишь вполне определенный липо-хром. Если кормить быков пищей, не содержащей типичного для них каротина, но богатой ксантофилом, то последний все же в К. не проникает. Обратные отношения найдены у кур (Hyman, Miiller; 1916).—Б и л и р у-б и н. Данных о сравнительном содержании билирубина у разных животных имеется очень много. Сыворотка собак его не содержит. В сыворотке свиньи, барана, козы, кролика и морской свинки найдены лишь его следы. У быка он содержится иногда в довольно большом количестве. У лошади имеется б. ч. 0,02%
о. Химия эритроцитов. Среднее содержание воды 62,5%. Содержание минеральных солей в эритроцитах у различных животных весьма различно. Так напр. у свиньи, лошади и кролика натрий совершенно отсутствует, в то время как у быка, козы и овцы его очень много; у человека его мало. Обратное отношение наблюдается в случае калия. Содержание Р
2О
б очень характерно для разных классов: 1,31°/оо Д
ля млекопитающих (1,902 для нежвачных, 0,727 для жвачных), 6,685 для птиц. Количество ж е-л е з а в общем всюду одинаково, равняясь в среднем 0,154% Fe
20
3. Исключением являются утки (0,229% Ре
20
3). Возможно, что это связано с их ныряющим образом жизни, требующим больших запасов 0
2 в крови.— Гемоглобин. В общем содержание НЬ у птиц (23,4%), если не считать уток, ниже, чем у млекопитающих (31,8%). Процентное содержание Млекопитающие Птицы, в том числе утки Утки одни Гематина .... Гемоглобина . . 0,111 1,26 31,8 0,115 1,30 27,1 0,160 1,82 38,2 Т. о. нет параллелизма между цифрами относящимися к содержанию железа и гематина с одной стороны и НЬ с другой. Возможно, что различные гемо глобины содержат неодинаковые количества железа или же что они неодинаковы в колориметрическом отношении. Разные гемо глобины могут отличаться друг от друга по своей способности к кристаллизации, по форме кристаллов, по поглощению света и по резистентности. Кристаллизация. Легко кристаллизуются и трудно растворимы оксигемогло-бины белки, крысы, лошади, собаки. Труд- Время разложения НЬ (в минутах). Животные */« NaOH
*и сн
8соон Человек ....... Свинья ........ Собака........ Кошка........ Бык........ 0,73 1.440,0 3,3 1,1 больше 1.440,0 1.290,0 80,0 21,0 137,0 11,5 21,5 40,5 40,0 132,0 26,0 49,0 330,0 153,0 191,0 41,0 64,0 141,0 172,0 7,7 , Лошадь....... Кролик ....... Морская свинка . . Голубь........ Угорь ........ Линь .... • . . . . нее кристаллизуется оксигемоглобин кошки-Очень трудно растворяется и легко кристал. лизуется оксигемоглобин человека, обезьяны, быка, овцы, свиньи, кролика, голубя и рыб (исключение—сельдь) (Ргеуег; 1871); форма кристаллов у большинства млекопитающих ромбическая, у белки—гексагональная, у голубя—тетрагональная, у хомяка — моноклиническая. Редуцированные гемоглобины легче растворяются и труднее кристаллизуются. При кристаллизации гниющей К. характер кристаллов может быть иной; так например у лошади могут полу- читься вместо нормальных призматических кристаллов ромбической системы также и гексагональные. Абсорпция света также определенно указывает на различие между различными гемоглобинами. К таким же результатам приводит и изучение их сопротивляемости по отношению к NaOH и СН
3СООН (см. табл. на ст. 638—внизу). Данные элементарного анализа эритроцитов. Элементы Животные Н | N Fe Лошадь . . . Кошка .... Морск. свинка Курица . 54,68 54,57 54,60 54,12 59,47 7,07 7,22 7,25 7,36 7,19 17,40 16,38 16,52 16,78 16,45 0,66 0,57 0,62 0,58 0,86 0,46 0,34 0,35 0,48 0,34 19,74 20,23 20,66 20,68 22,50 Т. о. на 1 атом железа у лошади приходится 2 атома серы, а у собаки 1 атом; у курицы на 2 атома железа—9 атомов серы. Форменные элементы. Эритроциты. Для функции дыхания имеет с одной стороны значение абсолютное количество НЬ в эритроците, а с другой—площадь его соприкосновения с окружающей средой, т. к. связывание 0
2 происходит лишь на его по- При сравнительном изучении Животных одного вида различие между средними числами, относящимися к отдельным особям, не превышает нескольких процентов, в то время как разница между отдельными эритроцитами одной особи может достигать 40%. Количество НЬ в одном эритроците колеблется для всех животных около средних цифр 30,3—31,7.Ю
-14 з. Однако необходимо отметить, что для плотоядных и всеядных животных получены в общем более высокие цифры, чем для травоядных. Число эритроцитов. Эритроциты имеются у всех позвоночных за исключением амфиокса (Amphioxus). Точное установление их числа стало возможным лишь в последнее время, когда выяснилось, что прежние авторы, работавшие с камерой То-ма-Цейсса, впадали в неизбежную ошибку, т. к. не учитывали того обстоятельства, что у различных животных быстрота оседания эритроцитов неодинакова. Поэтому особенно неточными оказались подсчеты числа эритроцитов у низших позвоночных, т. к. чем выше содержание в эритроцитах НЬ, тем быстрее происходит их оседание.—Недочеты камеры Тома-Цейсса избегаются при применении камеры Бюркера. Животные Число эр в 1
ммг Бюркер итроцитов (в млн.) Тома Разница в%
% нь в крови одном эритр. (в ю
-12 г) Скорость оседания в камере на о,1
мм (в сек.) Скорость оседания в 1 минуту (в
мм) Лягушка......... Голубь .......... 0,452 2,80 5,43 6,65 5,85 7,32 6,20 6,51 13,10 1,068 3,69 4,99 8,21 6,35 8,19 7,01 7,01 13,92 16—18 14,6 15,2 14—16,6 16,9 12,1 14,3 11,6 11,7 8,5 322 54 26—35 25 21 19 19 18 7 50 56—79 9,3 99 103 148 0,375 0,120 0,076—0,107 0,088 0,065 0,061 0,058 0,041 Собака.......... Кролик .......... Свинья ........... верхности. Поэтому принимают, что в общем мелкие, но многочисленные эритроциты свойственны гл. обр. животным с очень интенсивным обменом в противоположность животным с обменом более вялым, к-рые характеризуются более крупными, но менее многочисленными эритроцитами. Это отношение не является однако общим правилом. Для человека и домашних млекопитающих количество НЬ является величиной постоянной, вследствие чего всяким колебаниям количества НЬ отвечают определенные изменения числа эритроцитов. На
1/.12 поверхности эритроцита человека и домашних животных приходится 32.Ю
-14 г НЬ. Распределение НЬ на поверхности эритроцитов Животные Число эритроцитов в 1
мм3 (в млн.) Собака . Свинья . Кролик Бык . . Лошадь Овца . . Коза . . Человек Содержание НЬ в одном эритроците, выраженное в Ю
-12 г 6,59 7,44 5,86 5,72 6,94 10,70 13,94 5,00 24 22 20 19 18 11 8 30 Диаметр Поверх- (в /*) ность (в
цг) 7,26 82,7 6,60 68,4 6,60 68,4 5,94 55,4 5,94 55,4 4,62 33,6 4,00 25,1 7,92 98,4 С другой стороны ошибки возникали и от того, что не принималось во внимание, что жидкости, употреблявшиеся для наблюдений, были не ко всем эритроцитам применимы в одинаковой мере; так напр. жидкость Гайема, широко применяющаяся при исследовании К. человека, не применима для исследования К. козы и быка, т. к. вызывает у них аглютинацию и сморщивание эритроцитов, что не может не отразиться на точности исследования (Behrens; 1923). В общем размеры эритроцитов всегда обратно пропорциональны их числу; однако из этого правила имеются и исключения. Так, у ламы эритроциты крупнее, чем у человека; но число их доходит у нее в норме до 13 млн. против 5 млн. у человека; однако при этом толщина эритроцитов у ламы значительно меньше, чем у человека, вследствие чего и общий объем ее эритроцитов соответственно ниже, приближаясь к человеческой норме.— Среди всех позвоночных млекопитающие имеют наиболее многочисленные и в то же время наиболее мелкие эритроциты. Содержание НЬ на 1
ц3, выраженное в Ю
-14 з 29 32 29 34 33 33 32 31/ Животные Млекопитающие Обезьяна . . Человек . . . Собака .... Кошка .... Мышь черная » белая. Крыса . . . •Кролик . . . Морск. свинка Лошадь . . . Бык..... Коза .... Свинья.. . . Слон .... Овца .... Число эритроци-j тов(вмлн.); Диаметры В
IX Птицы Голубь. Ворон . Курица Утка . . Страус . Зяблик Рептилии Черепаха . . Ящерица . . . Амфибии Лягушка . . . Тритон.... Протей .... Рыбы Усач (кост.) Угорь « . Скат (попер. ротый) . . 6,000 5,000 4,420—7,225 7,300—9,900 8,700 8-^-9,725 9,300 4,840—6,410 3,600—5,859 6,300—7,400 5,070—6,275 9,720 5,440—6,960 2,020 11,800 2,010—4,000 2,420 2,400—3,100 2,800—3,020 1,620—1,600 3,660 0,629 1,650 0,393—0,467 0,103—0,165 0.036 1,283 1,100 0,140—0,230125X14 5,5—7,5 7,92 3,8—8 4,5—7,1 5,2—8,1 4,5—7,15 5,3—7,9 5,4—9,24 4,9—6,6 4,6—7,2 5,4 5,20—6 9,4 4,3 13,7X6.8 11,8X7,2 13,5X6,5 12,8X6,6 18,9 12,4X7,5 21,2X12,4 16,6X9,2 21,7X15 29,3X19,5 58,2X33,7 14,6X4, 15X12 Число лейкоцитов !НЬ в % 800 6.000 10.000 7.200—15150 4.140 7.320 15.200 8.200—8.150 7.240—15000 9.500 7.840 8.500 10—31.000 26—60.000 9.000 13.200 1.750 Приведенные цифры являются средними. Т. о. среди млекопитающих слон, имея наиболее крупные эритроциты, имеет наименьшое их число; среди птиц такое же положение занимает страус, среди рептилий и амфибий—протей. Из рыб хрящевые имеют по сравнению с костистыми наименьшее число эритроцитов.—Сравнительный объем эритроцитов и относительное содержание в них Hb видны из следующей таблицы. Животные Объем эритроцитов в
у? Содержание Hb в 1 ^ Человек .......... 0,416
тг 0,416 » 0,348 » 0,343 » 0,115 » Голубь .......... Лягушка......... Протей......... Зависимость числа эритроцитов от возраста. Число эритроцитов с возрастом увеличивается, за исключением быка, у которого в раннем возрасте число эритроцитов выше, чем у взрослых животных. Так, у морской свинки весом в 490
г и длиной в
23см число эритроцитов равно 5,3 млн.; у зародыша весом в 3,5 г и длиной в 3,2
см— 1,9 млн. Зародыш весом в 25,6 г и длиной в 11
см имеет 3,52 млн. эритроцитов, а новорожденная свинка (72 г, 12
см)—4,9 млн. эритроцитов (Bethe; 1891). У взрослого быка число эритроцитов 6,503 млн., а отношение числа лейкоцитов и эритроцитов 1 : 729; у теленка соответствующие цифры—8.523 и 1 : 548. Зависимость числа эритроцитов от пола. У мужчин число эритроцитов выше, чем у женщин (5,5 : 5,0). У половозрелых самцов их число, а также содержание Hb выше, чем у самок. У кастрированных животных эти числа ниже, чем у нормальных (см. ниже табл.). Очень сильные колебания числа эритроцитов наблюдаются у амфибий в зависимости от полового цикла, а в соответствии с этим и в зависимости от периода икрометания. Но совершенно естественно, что одновременно с этим сказывается и влияние окружающей среды (t°, влажность, питание). Зависимость числа эритроцитов от окружающих условий особенно заметна у водных животных; так, при содержании амфибий на суше у них происходит постепенное сгущение К. и соответственное относительное увеличение числа эритроцитов; у лягушки, потерявшей 13,1% своего первоначального веса, содержится в 1
mms 1.284.000 эритроцитов; после потери 34,8% веса их число равно уже 2.588.000 (Du-rig; 1901).—Р а з м е р ы эритроцитов сильно колеблются в зависимости от вида. Строение эритроцитов. Млекопитающие имеют круглые эритроциты за исключением мозоленогих (Tylopoda), у которых эритроциты имеют эллиптическую форму. Эллиптические эритроциты имеют также птицы,, рептилии, амфибии и рыбы. У миног эритроциты округлые. Для строения эритроцитов чрезвычайно важны вопросы существования у них оболочки и стромы. Вопрос об оболочке решается повидимому в том смысле, что на границе с окружающей средой, т. е. плазмой, наружный слой эритроцитов имеет характер двухфазной коллоидной системы (Berczeller; 1922). Но помимо этого в эритроцитах несомненно существует и преформированная строма, обусловливающая их определенную форму. В тесной связи со стромой стоят повидимому и т.'н. краевые обручи, лучше всего выраженные в эритроцитах многих амфибий и рыб (Meves; 1901). Эти обручи имеют фибрилярное строение и несомненно обусловливают характерную форму эллиптических эритроцитов, в том числе и эритроцитов ламы (Jolly; 1920). Некоторые авторы описывают их и у человека Животные Половозрелые животные Кастрированные животные Самцы Самки Самцы Самки Число эритроцитов (в млн.) Процент Hb по Сали 1 Число Процент эритроци- Hb по тов(вмлн.) Сали Число эритроцитов (в млн.) Процент Hb по Сали
Число эритроцитов (в млн.) Процент Hb по Сали Овца...... Свинья ..... 8,10 13,06 80 56 6,89 9,78 9,97 52 65 6,91 9,42 9,4 68 58 62 8,30 Б. М. О. т. XIV. (Romieu; 1922). Во всяком случае представляется весьма вероятным, что и так называемые кольцаКабота по своему происхождению сходны с указанными фибрилярными образованиями. Ядро. В зрелых эритроцитах ядра содержатся как правило лишь у птиц, рептилий, амфибий и рыб; но отдельные экземпляры встречаются у них и без ядер, что по всей вероятности связано с явлениями дегенерации, кариолиза и т. п. Но хотя у указанных форм присутствие ядра присуще как взрослым, так и эмбриональным эритроцитам, все же последние отличаются (особенно у амфибий) своими большими размерами. В онтогенетическом развитии эритроциты всех позвоночных проходят сначала стадий эри-тробласта—клетки с большим ядром и узкой протоплазмой. Следующий онтогенетический стадий, характеризующийся относительно Несколько меньшим ядром, является нормальной формой эритроцитов для рыб и амфибий; дальнейшее относительное уменьшение ядра приводит к виду, типичному для рептилий и птиц,'и наконец исчезновение ядра дает эритроцит млекопитающих. Т. обр. у низших классов позвоночных филогенетический тип эритроцитов определяется остановкой его развития на более раНнем онтогенетическом стадии (Minot; 1903). Кровяные пластинки. У млекопитающих кровяные пластинки имеют характер своеобразных мелких элементов, содержащих в протоплазме азурофильную зернистость. У всех низших позвоночных, начиная от птиц, пластинки или тромбоциты представлены веретеновидными клетками, напоминающими по своему строению эритроцит. Они имеют большое эллиптическое ядро, б. ч. с продольной складкой на оболочке. Протоплазма гемоглобина не содержит. В серологическом и иммунологическом отношениях тромбоциты низших позвоночных вполне соответствуют бляшкам млекопитающих. Размер веретеновидных клеток равен приблизительно
1/z—
х/з соответств. эритроцитов . Повидимому этим клеткам свойственны и фагоцитарные функции. г. Эпштойн. V. Общая масса К. Масса К. Широко распространенное представление, что общее количество К, равно у человека примерно
1/13 его веса, опирается на данные, полученные Велькером и Бишофом (Welcker, Bischoff) в 1856 г. у двух обезглавленных людей с помощью весьма несовершенных способов. В дальнейшем было придумано множество способов для определения массы К. in vivo; в наст, время применяются с этой целью гл. обр. два способа: вдыхание СО (ингаляционный способ) и введение коллоидальных красок (способ с красками). — Ингаляционный способ был предложен еще в 1882 г. Греаном и Кенко (Grehant, Quinquaud), но вошел в употребление лишь после того, как был усовершенствован и упрощен Голдейном и Смитом, Плешем и Уиплом (Haldane, Smith, Plesch, Whipple). Исследуемому человеку или животному дают вдохнуть определенное (безвредное) количество СО и по истечении нескольких минут определяют по способу Ван- Слайка и Сальвесена (Van Slyke, Salvesen) содержание СО в порции К., добытой из вены; в другой порции той же К. определяют с помощью
гематокрита (см.) отношение объема эритроцитов к плазме, на основании чего затем вычисляют массу эритроцитов (СО поглощается только ими) и общую массу К. Пример: вдохнуто 50 ем
3 СО; в 10
см3 К. найдено 0,2
см3 СО; объем эритроцитов в гема-токрите равен 45%. Масса эритроцитов рав- 50.10.0,45
-t чс\г- ч на:, —
~—■«= 1.125 еж
3; масса крови равна: 1.125 :0,45=2.500
см3.— Способ с краска м и был предложен в 1906 г. Котманом (Kottmann), но употреблявшиеся им краски (индиго, метиленовая синька) не годились для этой цели; лишь после того как Кис, Роунтри и Джирейти (Keith, Rowntree, Ge-raghty) в 1915 г., а вслед за ними и др. авторы показали безвредность и пригодность кислых коллоидальных красок (Vitalrot, Trypanrot, Trypanblau, Kongorot), способ этот стал применяться в широких масштабах. Принцип его заключается в том, что в вену исследуемого субъекта вводят определенное количество раствора краски и спустя 4 минуты (время, потребное для равномерного распределения краски в К.) из вены другой руки добывают нек-рое количество К. и сравнивают окрашенную плазму в колориметре со стандартом определенной концентрации.Так как краска эритроцитами не адсорбируется, то по степени концентрации ее в плазме можно подсчитать количество плазмы в организме, а общая масса К. вы-считывается затем на основании данных гематокрита. Существуют многочисленные вариации этого способа. Метод вливания коллоидальных красок дает менее точные данные при нефрозах и особенно амилоидозе (вследствие большей проходимости красок сквозь сосуды и, главное, вследствие элективной адсорпции краски конгорот амилоидной субстанцией) (Benhold, Griesbach); впрочем в первые минуты после введения краски, когда колориметрируют плазму, эти мешающие факторы еще не успевают достаточно проявиться.Также и при спленомегалиях получали красочным методом чрезмерно большие количества К. и объясняли это поглощением краски фагоцитарным аппаратом селезенки (Greppi, Hartwich, May); впрочем Вольский и Шевелева при малярийных спленомегалиях не нашли такого повышения массы К. Скорее при спленомегалиях можно ждать большей лябильности циркулирующей К. вследствие повышения селезеночного резервуара (см. ниже). В зависимости от применяемой основной методики исследования и той или иной ее модификации, полученные различными исследователями средние «нормальные» цифры массы К. резко расходятся между собой и колеблются между 48 и 92
см3 на 1
кг веса, не говоря уже о крайних цифрах (33
ем3 и 104
см3 на 1
кг). Особенно низкие средние цифры был^ получены с помощью ингаляционного способа (Голдейн и Смит—48
см3,. Плеш—53
см3); объясняется это тем, что с помощью этого способа выявляются лишь те эритроциты, к-рые в данный момент циркулируют в К., а до тех, к-рые находятся в селезенке и других депо эритроцитов, СО не доходит; когда Голдзйн и Дуглас (Douglas) удлинили промежуток времени между вдыханием СО и добыванием К. (время смешения) и СО успела благодаря этому проникнуть и в резервуары эритроцитов, то цифры массы К. получились гораздо более значительные—78
см3 на 1
кг.—Из исследователей, работавших красочным методом, Грисбах, Греппи, Гордон находили средние цифры К. между 66 и 75 см
3 на 1
кг веса; большинство же, и среди них Кис, Роунт-ри и Джирейти, Браун и Роунтри, Зейдер-гельм и Лампе (Seyderhelm, Lampe), находили от 83 до 92
см3 на 1
кг; по данным Черняка средняя норма = 83 ем
3, в том числе плазмы 44
сма, а эритроцитов 39
сма на 1
кз.—Т. к. средние цифры расходятся и у авторов, применяющих одну и ту же методику, то приходится допустить, что здесь (так же, как и в отношении индивидуальных различий, находимых каждым исследователем) играют роль конституциональные и социальные особенности, влекущие за собой различия в степени упитанности, развитии мускулатуры и жировой ткани. Все эти вопросы ждут еще своего разрешения.—Отчасти эта разница нормальн. средних величин массы К. у различных авторов объясняется тем, что до последнего времени не делали точного различия между массой циркулирующей К., находящейся в состоянии быстрого движения в кровяном русле, и массой крови в кровяных резервуарах или депо, где кровь как бы застаивается, выключаясь из активного кровообращения особыми механизмами (прежде всего в селезенке сокращением мышечных элементов Швейгер-Зейделевских капиляров, в печени благодаря сокращению шлюзового аппарата печоночных вен Арея и Симондса,в подкожном субпапилярном сплетении и т. д.). Опыты Дж. Баркрофта и его школы показали, что уменьшение величины селезенки (при повышении окружающей t°, при падении атмосферного давления, при физич. напряжениях, при аффектах гнева, пищеварении, беременности и нек-рых др. состояниях) сопровождается поступлением в общий ток этой резервуарной крови и тем может увеличивать общую массу К., а также изменять соотношение между плазмой и клеточной массой, т. к. кровь селезеночного депо, выбрасываемая при сокращении мышечных трабекуд ее в общую циркуляцию (sang de chasse Бине), гораздо богаче циркулирующей К. эритроцитами, лейкоцитами и пластинками (отчасти благодаря их седиментации в силу тяжести при стазе К.). Однако этот отдельный учет величины циркулирующей и резервуарной массы К. еще почти не использован клиникой кроме как в вопросе о различных типах сердечно-сосудистой декомпенсации (см.
Кровообращение). В клинике определение массы К. нашло довольно широкое применение при изучении разного рода анемических состояний и заболеваний, при к-рых предполагались т. н. «сгущение крови» и «плетора». Эти расплывчатые термины и особенно последний с его подразделениями способствовали возникновению ряда неправильных патогенетических представлений. Исследование массы К. дало Normovolaemia Hypervolaemia Hypov laemia. возможность заменить их вполне рациональными понятиями, предложенными Броуном и Роунтри и заслуживающими самого широкого распространения. При наличии нормальной массы К. они говорят о н о р м о -в о л е м и и, при увеличении массы К.— о г и-перволемии, при уменьшении ее—о г и-поволемии. В зависимости от соотношения между массой эритроцитов и плазмы (по гематокриту), они разделяют затем каждую из этих рубрик на простую (нормальное соотношение), полицитемическую (относительное увеличение массы эритроцитов) и олиго-цитемическую (относительное уменьшение этой массы). Т. о. получается 9 рубрик, в к-рые укладываются все изменения массы К. и к-рые дают ясное представление об этих изменениях. • • I simplex, polyeythaemica, • '
( oligocythaemica Масса К. при анемиях. После острых кровотечений у людей и экспериментальных кровопусканий у собак Смит, Плеш, Уипл и др. нашли, что потеря К. очень быстро замещается соответствующим увеличением массы плазмы, вследствие чего масса К. может даже превысить первоначальную, особенно при быстром наступлении регенерации эритроцитов. При хронич. кровотечениях может однако наступить й заметное уменьшение массы К. (Плеш, Грисбах, Мендерсгаузен, Черняк), но почти исключительно за счет массы эритроцитов (hypovolaemia oligocythaemica), масса же плазмы остается почти неизмененной или даже нарастает. При т. н. вторичных анемиях различного происхождения Кис, Роунтри и Джирейти, Грисбах находили массу К. нормальной; Гордон, Гартвих и Мей нашли увеличение относительной массы К. (очевидно в связи с исхуданием б-ных), но некоторое понижение абсолютной; сходные данные—у Чиприани и Джорджио (Cipriani, Giorgio); в случаях Черняка и абсолютная и относительная масса К. оказалась в пределах нормы (в среднем—82,6
см3 на 1 кг). При этом однако оказывается резко нарушенным соотношение между эритроцитами и плазмой: масса первых резко понижена (23,7
см3 вместо 39), масса второй повышена (58,9
cmz вместо 44). Т. о. для «вторичных анемий» можно считать характерным тип normovolaemia oligocythaemica.— При пернициозной анемии масса К. колеблется в зависимости от стадия б-ни:, во время ремиссии она бывает нормальной, во время рецидивов—уменьшается, причем масса плазмы нарастает, но не может компенсировать убыли эритроцитов; в предсмертный период («кома») Мендерсгаузен находил новое нарастание массы К. вследствие разжижения (Verwasserung) плазмы. По данным Рушняка (Rusznyak) масса К. при пернициозной анемии нормальна, а во время ремиссии увеличена. —При лейкемии определение массы К. затрудняется сплено-мегалией (см. выше); Кис, Греппи получали очень большие цифры; однако Мендерсгаузен нашел в трех случаях олигоцитемиче-скую гиповолемию или нормоволемию. Такие же данные получил юн в трех случаях •21 лимфогранулематоза.—При хлорозе данные авторов расходятся: Смит и Плеш находили значительную гиперволемию, Грис-бах—как гипер-, так и гиповолемию, Гарт-вих и Мей—гиповолемию при нормальной массе плазмы. Масса К.при политлобулиях. Большой интерес представляют данные, полученные относительно истинных полицитемий Ва-кеза и Гайсбека (Vaquez, Gaisbock). Во всех таких случаях было найдено значительное увеличение общей массы К., доходящее в одном случае Броуна и Гриффина (Brown, Griffin) .до 224
см3 на 1
кг. Зейдергельм и Лампе обратили при этом внимание на то обстоятельство, что при polycythaemia ru-bra Vaquez всегда наблюдается увеличение относительной массы эритроцитов, достигающей иногда 80% массы К. (полицитемиче-ская гиперволемия), в то время как при полицитемий Гайсбека соотношение между массой эритроцитов и плазмы остается б. или м. нормальным (простая гиперволемия или, по Зейдергельму и Лампе, полиемия).—Из симптоматических полиглобулий следует отметить полиглобулию, наблюдаемую при tbc легких. Противоречие между наружной бледностью этих б-ных и составом их К. было объяснено в свое время Гравицем (Grawitz) как следствие «сгущения К.», маскирующего фактическую анемию. Исследования массы К., произведенные Бригером (Brieger) у 23 туб. б-ных, показали однако, что'ни общая масса К. ни масса плазмы у них не уменьшены, а при значительном исхудании могут быть даже относительно увеличены. Такие же данные можно найти у Мендерсгаузена. Исследования Черняка дали у туб. б-ных среднюю массу К. в 86
см3 на 1
кг, а плазмы—48
см3. Гипотезу Гравица следует поэтому отвергнуть, а полиглобулию туб. больных признать вполне реальной.—При врожденных пороках сердца, сопровождающихся полиглобулией, Плеш и Грисбах нашли резкое увеличение массы К. за счет эритроцитов при нормальном или даже слегка пониженном количестве плазмы (полицитеми-ческая гиперволемия).Изменения массы циркулирующей К. при состояниях коляпса и при сердечной декомпенсации, см.
Кровообращение, патология. Относительно болезней почек издавна установилось мнение, что сопровождающие их анемия, отеки и гипертония обусловлены
гидремией (см.) или «гидремиче-ской плеторой» (см.
Плетора). Многочисленные исследования массы крови показывают однако, что увеличение ее наблюдается примерно лишь у половины нефротиков, у другой же их половины и у нефритиков имеется нормо- или гиповолемия, а у анемичных— олигоцитемическая гиповолемия. Анемия брайтиков представляет собой т. о. истинную анемию (Зейдергельм и Лампе, Броуы и Роунтри) гипорегенераторного типа (Та-реев). Образование отеков и их уменьшение сопровождаются и у почечных б-ных значительными колебаниями массы К.; однако какого-либо постоянного соотношения между «отеками крови» и тканевыми отеками не наблюдается (Броун и Роунтри, Тареев). Не существует определенной зависимости и между массой К. и нефритической гипертонией (Тареев).—Что касается других видов гипертонии, то имеются наблюдения о параллелизме между колебаниями кровяного давления и массы К. (Грисбах, Плеш); однако все авторы согласны между собой в том, что высота давления не обусловливается массой К. Из других пат. состояний можно отметить уменьшение относительной массы К. и плазмы при тучности. После падения веса наблюдается как увеличение, так и уменьшение массы К. (Броун и Кис). В связи с этим следует указать на наблюдения Томпсона (Thompson) и Черняка, видевших нарастание массы К. у микседематозных под влиянием тиреоидина. Наоборот, под влиянием инсулина масса К. по данным Вилла (Villa) заметно уменьшается. Изменения массы К. наблюдаются под влиянием пилокарпина, атропина, морфия, эфирного наркоза (Грисбах).—Из физиол. состояний, влияющих на массу К., следует отметить беременность, при к-рой большинство авторов находит гиперволемию, Нейбауер (Neubauer) же нашел нормальную массу К.—У новорожденных найдена относительная гиперволемия при пересчете на 1
кг веса и уменьшение массы К. при пересчете на поверхность тела (Зейдергельм и Лампе).
я. Черняк. VІ. Соотношение между
форменными элементами и
плазмой К. К. представляет взвесь форменных элементов (эритроцитов, лейкоцитов и пластинок) в жидкой плазме. Предоставленная самой себе К. вне организма скоро нацело свертывается; соотношение сыворотки, отделяющейся затем вследствие ретракции кровяного сгустка, к этому сгустку не повторяет исходного соотношения жидкой части и форменных элементов К. из-за выпадения фибрина и различной компактности кровяного сгустка. Б. или м. правильное представление о богатстве К. плазмой можно себе составить, если К. дефибринировать и предоставить ее самостоятельной седиментации. Чтобы избежать дефибринирования и лучше сохранить эритроциты, Маркано (Магсапо) разводил К. формоловым раствором Na
2S0
4 с добавлением NaCl, оставлял К. стоять в маленьком градуированном коническом сосуде и по величине отстоя высчитывал процентное содержание форменных элементов в крови. Бер-нацкий (Biernacki) вместо разведения К. добавлял минимальные количества оксалата (2
мг на 1,0), а Гравиц по тому же принципу сконструировал особый прибор—Blutvolu-minimeter. Однако при самостоятельном се-диментировании между кровяными тельцами остаются заполненные плазмой межклеточные пространства, поэтому более точные результаты получаются при механическом центрифугировании. Такой аппарат,
гематокрит (см.), по модели лактокритов молочной индустрии, был сконструирован Гедином (He-din) и широко применялся Даланом (Da-land). Гематокрит представляет пару градуированных капилярных трубок, укрепленных в особый металлич. штатив с приспособлением для центрифугирования. Гедин прибавлял к К. оксалата 1 :1.000 и разводил К. перед центрифугированием равным объемом 0,9%-ного раствора NaCl. Получить действительно точные данные с гематокритом оч^нь трудно, т. к. оксалат и цитрат in substantia вызывают значительные изменения объема эритроцитов, а также гемолиз; изотонические же растворы их часто являются н
г изотоническими для пат. крови. Грисбах предварительно дефибринирует К. (потеря эритроцитов при этом так невелика, что не открывается сравнительным подсчетом). Лучше прибавлять к К. гирудин (или гепарин). Кеп-пе и Капе (Коерре, Capps) при быстром манипулировании, пользуясь мошной центрифугой с 5.000 обор, в минуту, обходятся без всякого антикоагулянта или довольствуются парафинированием капиляров; разделение К. на слои происходит при этом так быстро, что свертывание предотвращается, и в то же время так полно, что удаляется вся м°жклеточная жидкость; это изменяет обычные условия преломления света, и столбик эритроцитов представляется прозрачным, лакированным (в отсутствии гемолиза). За неимением такой центрифуги предпочтительно работать с большим количеством К. в точно калиброванных центрифужных пробирках на 15
смъ, что дает большую точность результатов. Процентное содержание плазмы в К. можно определить также косвенным путем по содержанию какого-либо вещества в цельной К. и в плазме (правило смесей). Так, Бунге (Bunge) для этой цели использовал факт нахождения у нерс-рых видов животных Na исключительно в плазме и отсутствия его в эритроцитах. Гоппе-Зейлер (Hoppe-Seyler) с той же целью определяет содержание фибрина в цельной К. и в плазме. Можно определить также распределение добавленного не проникающего в эритроциты индиферент-ного вещества или нек-рые физ.-хим. свойства К. и плазмы, резко отличные для форменных элементов и жидкой части (напр. электропроводность-—Hober), уд. вес (Гра-виц), вязкость и особенно рефрактометрию (Alder). В результате всех приведенных методов найдено, что форменные элементы составляют в норме несколько менее половины всей К., в среднем44%. Фрелих (Froeh-lich) приводит цифры в 45,13% для мужчин и 41,38%—для женщин. Цифры других авторов часто колеблются в значительно более широких пределах. Венозная К. содержит большой объем эритроцитов вследствие их разбухания от С0
8. Мышечная работа вызывает увеличение общего объема эритроцитов вследствие повышения. числа их, вызванного сокращением селезенки (Баркрофт). У различных млекопитающих описаны большие колебания нормального объема эритроцитов [27,8 у козы и 39,4 у свиньи (Goetze)]. В патологии человека в зависимости от анемий или эритроэмий колебания составляют от 9% до 80%. Определение объема эритроцитов имеет значение для изучения колебаний величины отдельного красного тельца и насыщения его НЬ. Т. н. объемный индекс Капса (Volume index), выражающий отношение процентного изменения массы эритроцитов к процентному изменению количества их в данной К., является постоянной величиной в норме и дает характерные отклонения при различных формах анемий: понижение при вторичных и повышение припернициоз-ной анемии; при последней это повышение объемного индекса является более ранним признаком, чем повышение цвртного показателя (Haden).Индекс насыщения, напротив, и при пернициозной анемии остается ниже нормы, т. е. повышение цветного показателя происходит только за счет величины шарика. При самопроизвольном оседании или при центрифугировании К. более легкие ядерные эритроциты, ретикулоциты и эритроциты с малярийн. паразитами накапливаются преимущественно в верхних слоях, чем можно пользоваться для обогащения мазков соответствующими элементами. Над столбиком эритроцитов в гематокрите скопляется слой лейкоцитов (около 1 % в норме и значительно больше при лейкемиях). Пластинки располагаются в верхних слоях; путем повторного центрифугирования можно изолировать пластинки почти в чистом виде, особенно из К. лошади. Надо помнить, что в циркулирующей К. происходят между эритроцитами и плазмой значительные взаимные перемещения воды, солей, белка и т. д. под влиянием работы органов, обмена веществ и пр., в соответствии с чем известное процентное соотношение плазмы и форменных элементов не является величиной ПОСТОЯННОЙ.
Е. Тареев.
VІІ. Морфологический состав К. и методика его исследования. Морфологический состав крови. У здоровых людей К. натощак обнаруживает довольно постоянный морфол. состав, колеблющийся в сравнительно узких пределах, в особенности для одного и того же индивидуума. У разных людей колебания морфол. состава крови могут быть обусловлены полом, возрастом, климатическими, расовыми факторами, а также различными иными гено- и паратипическими факторами. Изменения морфол. состава К., в особенности при повторных исследованиях у одного индивидуума, имеют большое диагностическое значение и широко применяются в клинике. Обычно для диагностических целей пользуются определением количества форменных элементов К. (эритроцитов, лейкоцитов и тромбоцитов) путем их исчисления (см.
Камеры счетные), а также изучением их качественного состава (см.
Лейкоцитарная формула, Гемограмма, Эритроциты, Виц-цоцеро бляшки) и определением количества НЬ. Количество красных кровяных шариков у взрослого мужчины обычно колеблется в норме между 4,5—5 млн. в 1
мм3, у женщины—между 4—4,5 млн. в 1
мм9. Количество тромбоцитов колеблется в норме от 130 до 750 тыс. (обычно 250—300 тыс.).Коли-чество белых кровяных шариков колеблется в пределах 6—8 тыс. Всякие сдвиги и отклонения от приведенных количеств принято считать патологией. Качественный состав К. изучается в сухих препаратах, resp. в толстой капле, после предварительной окраски их (см. ниже—Методика исследований). Таким путем вычисляется т. н. лейкоцитарная формула, определяется характер, величина, насыщенность пигментом, особенно- сти формы, патолог, включения в эритроциты, зернистость, строение ядра лейкоцитов, а также количество и особенности структуры тромбоцитов. Количество НЬ определяется при помощи
гемометров (см.). Подробнее, а также о всех отклонениях от нормы различных элементов крови, см.
Анемия, Анизоци-тоз, Грудной ребенок, Гемограмма, Гемоглобин, Лейкемия, Лейкоциты, Лейкоцитоз, Лейкопения, Лейкоцитарная формула крови, Эритроциты и соответствующие статьи об отдельных заболеваниях. Методика исследования. Морфо-логическ. исследованием К. устанавливается количественный и качественный состав ее форменных элементов. Исследование это носит или чисто научный характер или же преследует практическую цель как вспомогательный метод для установления диагноза б-ни и ее течения. Для такого исследования требуется небольшое количество К., которое у человека легко добывается уколом кончика пальца или мочки уха. Кожа предварительно очищается и обезжиривается—обмывается теплой водой с мылом, затем эфиром и спиртом. Негели (Naegeli) рекомендует при взятии К. из пальца нагревать руку в

Рис."1.
горячей воде для получения активной гиперемии и для того, чтобы не нужно было К. выжимать. Лучше всего брать кровь утром натощак. Укол производится обычно иглой Франка (рис. 1) или же стальным пером, у которого нужно отломать половину острия. Первая капля стирается, а затем каждый раз берется свежая. У животных (кролик, морская свинка и др.) К. берется путем укола вены уха иглой от шприца; у мышей и крыс—срезается кончик хвоста; у рыб—надрезывается плавник; у птиц К. получается уколом гребня или из вены крыла. Сначала кровь набирается в пипетку для определения количества НЬ
(см.'Гемометры), а затем в смесители для красных и для белых кровяных телец для подсчета их в камерах (счет эритроцитов—см.
Камеры счетные). Для разведения пользуются или 3%-ным раствором NaCl или же жидкостью Гайе-ма (см.
Гайема раствор).—Необходимо следить, чтобы не было пузырьков воздуха, а также чтобы не образовалось сгустков К. Легким встряхиванием в продолжение 2— 3 мин. достигается равномерное распределение элементов взвеси в ампуле смесителя, в к-рой для этой цели помещена стеклянная бусинка.—Для наполнения камеры небольшая капля взвеси наносится на середину ее и затем быстро покрывается покровным стеклом; последнее сначала ставится на один край под острым углом, затем быстро опускается; первые капли из смесителя предварительно выпускаются на фильтровальную бумагу. Камера должна быть заполнена взвесью, не должно быть пузырьков воздуха, жидкость не должна выходить за пределы желобка, окружающего камеру. По обеим сторонам желобка снаружи поверхность слег- ка увлажняется, чтобы покровное стеклышко лучше пристало и образовались Ньютоновы кольца. Техника подсчета—см.
Камеры счетные.—Для человека средняя норма— 4.500.000—5.000.000 эритроцитов в 1 лш
3. Счет лейкоцитов. В смеситель Тома, за ампулой к-рого имеется пометка
11 (разведение в 10 раз), набирается К. до пометки
1,0 (при лейкоцитозах до
0,5). При лейкемиях с высокими цифрами лейкоцитов пользуются смесителем для эритроцитов. Жидкостью для разведения служит разведенная уксусная к-та с примесью краски для выявления ядер лейкоцитов: Acid. acet. glac.—■ 3,0, Gentiana violett (1%-ный водный раствор)—3,0, Aq. dest.—300,0. Техника подсчета—см.
Камеры счетные. Средняя норма количества белых кровяных телец для человека 6.000—8.000 в 1
мм3.—Для подсчета кровяных пластинок Биццоцеро по общепринятому методу Фонио (FonioVna кончик пальца сначала наносится капля 14%-ной Magnesium sulfuricum, через нее делается укол, затем выступающая капля крови смешивается с каплей раствора и делается мазок на предметном стекле (каплю раствора Magn. sulfur, можно наносить и после укола). Мазок окрашивается лучше всего по Гимза» затем в окуляр вставляется окошко, предложенное Шиллингом (Schilling) для удобства подсчета пластинок и эритроцитов. Подсчитав, сколько кровяных пластинок приходится на тысячу эритроцитов, можно вычислить их содержание в 1
ммь К., определив предварительно количество эритроцитов в 1
мм5. Кроме метода Фонио имеется много др. методов. ■—Определение цветного показателя (Farbeindex). Из полученного в процентах количества НЬ и количества эритроцитов в
1mmsвычисляется т. н. цветной показатель, т. е. показатель содержания НЬ в каждом эритроците. Вычисление это основано на предпосылке, что в норме имеется максимальное насыщение эритроцита гемоглобином. Норма соответствует 100% НЬ при 5.000.000 эритроцитов в 1
мм3. Цветной показатель высчитывается по формуле: р-г
найден, колич. НЬ . найден, колич. эритроц. __
1 — юо ' бТооо.ооо " ~ _
найден, кол
ич. НЬ х
5.000 000 — 100 х найден, колич. эритр. Норм, цветной показатель = 1; при гипер-хромии цветной показатель выше единицы, при гипохромии—ниже
(см.Гиперхромазия). Дальнейшее исследование кровяных телец ведется в трех направлениях. I. Исследование в свежем виде. Капля К. наносится на предметное стекло и покрывается покровным стеклышком (стекла всегда должны быть хорошо вымыты и обезжирены). Препарат замазывается по краям парафином. К. теплокровных рассматривается при длительном наблюдении под микроскопом на нагревательном столике—удобнее всего электрический столик с легко регулируемой t°. Эритроциты складываются в характерные монетные столбики; свободные эритроциты местами выявляют бисквитооб-разную, двояковогнутую форму, нек-рые из них имеют вид колокольчика. Здесь же уста- навливается, имеется ли
пойкилоцитоз (см.) или
апизоцитоз (см.) эритроцитов. В пат. случаях в эритроцитах могут быть обнаружены вакуоли.—Из гранулсцитов особенно резко выступают эозинофилы благодаря их блестящей крупной зернистости. Через некоторое время выступают нити фибрина со скоплениями кровяных пластинок. Грануло-циты и мононуклеары выявляют амебоидное движение; лимфоциты передвигаются крайне медленно. При малярии иногда обнаруживается пигмент в мононуклеарах и в ней-трофилах. Этот же препарат при исследовании в темном поле зрения (Dunkelfeld) выявляет более резко зернистость нейтрофи-лов, перемещающуюся соответственно имеющимся в клетке протоплазматическим токам; при отмирании клетки зернистость начинает выявлять Броуновское движение. В мононуклеарах также выявляется зернистость (Naegeli). Хорошо видны в темном поле также гемоконии—липоидные частицы. Прекрасно видны в темном поле зрения паразиты К.—спирохеты и трипаносомы. II. Исследования форменных элементов в окрашенном виде. Клетка К., как и всякая другая клетка организма, подчиняется по отношению к красящим веществам определенным законам, обусловленным свойствами ее мембраны и структуры. В виду того что как проницаемость клеточных мембран, так и окрашиваемость клеточных структур различны у живой и у мертвой клетки, окраска кровяных клеток может быть прижизненной и посмертной; как межуточное звено сюда входит т. н. предсмертная, или поствитальная окраска отмирающих клеток. — 1. Прижизненная окраска разделяется согласно закону проницаемости живой оболочки на две группы: 1) окраска основными и 2) кислыми красками.—1) Прижизненная окраска с помощью основных красок. Из основных красок в гематологической технике применяются для прижизненной окраски гл. обр. Neutralrot и Janusgrun. Однако многие авторы считают и эту окраску атональной. Основные краски как растворимые в липоидных смесях, входящих в состав клеточной оболочки, легко проникают в клетку, окрашивая здесь преформи-рованные структуры, гл. обр. адсорбируясь на их поверхностях. Как и многие другие органические красящие вещества, так и Neutralrot является индикатором реакции; он меняет свою окраску в зависимости от реакции среды, в к-рой он находится. Изменение цвета окрашенных Neutralrot'ом образований вплоть до полного их обесцвечивания является т. о. очень тонким реактивом для выявления изменчивости протоплазмы. Проникая в протоплазму клетки, Neutralrot окрашивает особые образования—гранулы; Janusgrun считается специфич. краской для митохондрий.—Окрашивание К. Neutral-* г о t-J anusgrun по способу Сабина (Sabin). Для этой окраски заготовляются два раствора: 1) Neutralrot 0,1
г на 10
см3 абсолютного алкоголя и 2) Janusgrun—спиртовой раствор такой же концентрации. В день исследования (или накануне) к 5
см3 абсолютного спирта прибавляется 20 капель | первого раствора и 15 капель второго, взбалтывается и наносится на предметное стекло, тщательно вымытое так, чтобы краска свободно стекала со стекла, поставленного вертикально на фильтровальную бумагу. После того как стекло, покрытое краской, совершенно высохнет, на него наносится капля исследуемой крови, покрывается покровным стеклышком и кладется на
х/г часа во влажную камеру. Окраска считается законченной после того, как в протоплазме лимфоцитов и мононуклеаров выявлены оранжевые Neutralrot - гранулы и митохонд-ральная зернистость (окрашенная Janusgrun'ом в зеленый цвет); Neutralrot-грану-лы имеются также в нейтрофилах. Ядра лейкоцитов остаются совершенно бесцветными. Сабин считает характерным для нормальных мононуклеаров розеткообразное расположение Neutralrot-гранул соответственно центросфере. Однако часто встречаются и отклонения. Расположение Neutralrot-гранул розеткой имеется также и в миелобла-стах. В эритробластах также обнаруживаются Janusgrim-митохондрии и Neutralrot-гранулы. Как Janusgrtin-митохондрии, так и Neutralrot-гранулы сохраняются некоторое время в молодых эритроцитах. В норме они обнаруживаются в незначительном количестве (1—5 в препарате), при усиленной регенерации число их увеличивается до многих в каждом поле зрения. При отмирании эритроцитов гранулы и митохондрии начинают выявлять Броуновское движение и затем исчезают, после чего через некоторое время начинает окрашиваться зер-нисто-нитчатая субстанция (см. ниже) Neutralrot'ом. На основании этого Фрейфельд считает окраску Neutralrot-Janusgrun прижизненной, тогда как другие авторы считают ее предсмертной. 2) Прижизненная окраска кислыми красящими веществами. Способ проникновения в клетку кислых красящих веществ, нерастворимых в липоидах, совершенно иной, нежели основных: эти вещества попадают в клетку благодаря физиол. изменчивости ее оболочки (физиол. проницаемость по Hober'y); иначе говоря, они попадают в клетку путем фагоцитоза. Поэтому чем большей фагоцитарной способностью обладает данная клетка, тем легче она окрашивается кислыми красками. Прижизненной окраской кислыми красками пользуются, впрыскивая их животным. — Инъекция Lithioncarmi n'a поРибберту (Rib-bert). Берется по возможности концентрированный раствор краски и тщательно профильтровывается. Йнъицируется в вену 5— 10
см3 и больше смотря по величине животного. Исследуются периферическая К. и органы животного.—Indigocarmin по Гейденгайну (Heidenhain) вводится животным внутривенно в виде 0,4%-ного водного раствора, количественно в зависимости от веса животного; так, кролики получают 35—60
см5, собаки—150—1.500
см*. Через различные промежутки времени животное убивается, органы промываются через артерии абсолютным спиртом и фиксируются в абсолютном спирту.— Инъекции Pyrrol I или Isaminblau по Гольдману (Goldmann). Берется 1%-ный водный раствор по 1
см3 на 20 з веса животного (место инъекции массировать); впрыскивания делаются повторно через 6—-7 дней. Органы фиксируются в формалине и режутся на замораживающем микротоме. Фагоцитированная краска обнаруживается в нек-рых моно-нуклеарах-и в ретикуло-эндотелии органов. 2. Предсмертная (суправиталь-ная) окраска. Наиболее употребительными являются Brillantkresylblau, Nilblau-sul'fat, Methylviolett, Neutralrot, Methylen-azur. Для этого исследования удобнее пользоваться не каплей К., покрытой покровным стеклышком, а мазками К. Мазок может быть сделан на предметном или на покровном стекле, как это видно на рис. 2. Для маз-
Рисунок 2.
ка берется вторая или третья капля К., появляющаяся на месте укола при легком нажиме. К выпуклости капли быстро прикладывается предметное стекло, приблизительно на палец отступя от края длинника стекла, затем левой рукой фиксируется предметное стекло, а правой к капле вплотную подводится покровное стеклышко; капля К. распределяется по его краю и при продвижении следует за ним. Т.о. получается равномерный, не доходящий до краев предметного стекла мазок. Мазок на покровном стеклышке делается т. о.: стеклышко быстро прикладывается к капле крови; вокруг полученной капли на стеклышке образуется налет от пара, к-рый быстро исчезает; тогда капля при наложении другого покровного стеклышка в силу капилярности распределяется между обоими стеклышками, к-рые затем быстро разъединяются, как указано на рис. 2. Мазки должны быть сделаны тщательно, т. к. они в значительной степени определяют возможность получения хорошего препарата.— Окраска Brillantkresylblau. Приготовляется насыщенный в абсолютном спирте раствор краски (приблиз. 1 з Brillantkresylblau на 80
см3 абсолютн. спирта). На подогретое предметное или покровное стекло стеклянной палочкой наносится немного раствора краски и быстро размазывается другим предметным стеклом (наподобие мазка К.); на стеклр получается едва заметный синевато-лиловый налет. Приготовленные т. о. стекла пригодны для употребления в течение продолжительного срока. На покрытом краской стекле делается затем обычным способом мазок К., к-рый тотчас же (влажным) переносит- ся на 3—5 мин. во влажную камеру; последняя представляет собой чашку Петри или чашку Дригальского, в к-рой по окружности уложен валик влажной фильтровальной бумаги (на дне камеры воды не должно быть). В камере Brillantkresylblau окрашивает зер-нисто-сетчатую субстанцию эритроцитов; затем препарат вынимается из камеры и оставляется на воздухе сохнуть, после чего рассматривается под иммерсией (см. отд. табл., рис. 2). В среднем К. здорового человека содержит от 1°/оо ДО 8°/оо ретикулоцитов, т. е. молодых эритроцитов с substantia granulo-filamentosa.—Относительно происхождения зернисто-нитчатой субстанции мнения авторов расходятся. Так, Шиллинг считает ее дериватом базофильной стромы полихрома-тофильных эритроцитов, тогда как Сабин и др. авторы считают, что зернисто-нитчатая субстанция происходит из митохондрально-го аппарата. Шиллинг комбинирует окраску Brillantkresylblau с окраской по Гимза т. о., что окрашенный витально мазок фиксируется 3 мин. метиловым спиртом, а затем красится обычной смесью Гимза. Препараты получаются очень красивые; однако часть витальной зернистости нередко пропадает; поэтому для подсчета такие препараты менее' пригодны.—Совершенно аналогична техника окраски Nilblausulfat'oM. Шиллинг рекомендует ее для выявления эритрокон-тов в эритроцитах при пернициозной анемии и при гемолитических анемиях. Окраска метилв полетом телец Гейнца (Heinz). При отравлении кровяными ядами (анилин, нитробензол, бертолетова соль, мышьяковистый водород и др.), ведущими к образованию в крови мет-гемоглобина, в эритроцитах появляется одно или несколько телец, т. н. тельца Гейнца, к-рые не всегда хорошо прокрашиваются при вышеописанном способе Brillantkresylblau и очень хорошо выступают при окраске метилвиолетом (1
г метилвиолета растворяется в 100
GMZ 0,6%-ного водного раствора NaCl). К капле К. на предметном стекле прибавляется капля указанного раствора, покрывается покровным стеклом и сохраняется во влажной камере. Тельца Гейнца выступают в виде темнофиолетового цвета зерен (см. отд. табл., рис. 4 и 5). 3. Окраска фиксированных мазков крови. Этот способ исследования крови имеет наибольшее применение в гематологии. Окраска препарата требует его предварительной фиксации, для чего пользуются различными фиксирующими жидкостями (или парами), а также высокой темп. От быстроты и качества фиксажа в значительной мере зависит эффект последующей окраски. Растворы нек-рых красок одновременно фиксируют и окрашивают прг -парат. П. Эрлих (P. Ehrlich), окрашивая белые кровяные тельца Triacid 'ом, считал, что можно с помощью красок произвести хим. анализ клетки в том смысле, что щелочные ее составные части окрасятся кислыми красками, а кислые—щелочными красками. Соответственно этому лейкоциты в зависимости от окрашиваемости их зернистости были подразделены на нейтрофилы, эозинофилы и базофилы. Однако неправильность основ- яых положений этой теории была вскоре доказана учеником Эрлиха Михаелисом (Mi-chaelis), к-рый показал всю сложность процессов, протекающих при окрашивании, и установил, что здесь роль хим. процессов обычно невелика, а на первый план выступают физ.-хим. процессы (см.
Гистологическая техника). Окраска фу к синофи л ьно й зернистости лимфоцитов поШридде (Schridde) и митохондрий по способу Шридд е-А л ь т м а н а. 1) Тонкий свежий мазок К. на предметном стекле тотчас фиксируется в Formol-Miiller (1 : 9) в течение 1—2 часов. 2) Промыть несколько минут в проточной, а потом в дестилированной воде. 3)
1/2 часа в 1%-ном растворе осмиевой к-ты (в темноте). 4) Быстро промыть в воде. 5) Окраска в следующем растворе: 100
смг насыщенного на холоду фильтрированного раствора анилина в дестилированной воде + +20 г кислого фуксина. Профильтровать. Краска наливается высоким слоем на предметное стекло, нагревается 5—6 раз над пламенем, каждый-раз до появления небольших паров, затем совершенно охлаждается. 6) С краев предметного стекла стирается фильтровальной бумагой подсохшая краска, затем препарат диференцируется в растворе из одной части насыщенного спиртового раствора пикриновой кислоты и семи частей 20%-ного спирта, пока не станет желтоватым. 7) Промыть в абсолютном спирту. 8) Ксилол. Канадский бальзам.—Этим способом Шридде выявил фуксинофильную зернистость в лимфоцитах, считая ее специфической для этого вида клеток, т. к. ни в миело-бластах, ни в эритробластах при этой окраске они не выявляются. Фрейфельд модифицировала Шридде-Альтмановскую окраску, фиксируя препараты до часа в 1 %-ной осмиевой к-те и применяя слабое нагревание мазков К., сделанных на покровном стеклышке, над небольшим пламенем спиртовой лампочки в течение 15—20 мин. Препарат многократно подогревается, пары не должны появляться. При такой технике фуксинофиль-ная зернистость характера митохондрий обнаруживается в лимфоцитах, мононукле-арах, миелобластах, эритробластах, а также в очень молодых эритроцитах (см. отд. табл., рис. '3). Клейн (Klein) работал сходной методикой и пришел к аналогичным результатам.— Окраска Triacid'oM Ehrlich'a. Triacid содержит в растворе Methylgrim, у к-рого три основные группы насыщены двумя кислыми красками: Orange G и кислым фуксином. 1) Мазок К. (лучше на покровном стеклышке) давностью 1—2 суток фиксируется жаром на подогретой медной пластинке в том месте, где нанесенная на нее капля воды не закипает, а скатывается в виде шарика (феномен Leidenfrost'a); время фиксации— 10—20 сек.; стеклышко кладется мазком вниз. 2) Краска наливается пипеткой на препарат и держится 5—10 мин. 3) Промывка водой, пока перестает отходить краска. 4) Высушить фильтровальной бумагой. Канадский бальзам. Зернистость нейтрофилов четко окрашивается в красновато-фиолетовый цвет, зерна эозинофилов—яркомедно-красного цвета (см. отдельную таблицу, рис. 6). В остальных кровяных тельцах зернистость не выявляется. Ядро окрашивается диффузно, бесструктурно в голубовато-зеленоватый цвет, местами с выпадением тем-нозеленых зерен. Окраска Е о s i n-Me thy le nb lau (Jenner, May и Grtinwald). Препарат окрашивается тотчас после изготовления. Краска растворена в метиловом спирте и поэтому предварительная фиксация опускается. 1) На препарат наливается на 2—3 мин. неразве-денная краска. 2) Приливается столько дестилированной воды, сколько прежде было налито краски. Красить в продолжение 5—- 15 мин. 3) Основательное промывание в дестилированной воде, пока препарат становится розовым. 4) Просушить'. Канадский бальзам. При этой окраске прекрасно выявляется зернистость базофилов, эозинофилов и нейтрофилов (см. отд. табл., рис. 7); остальные белые кровяные тельца без зернистости в протоплазме. Сходную картину дает окраска по Лейшману (Leishman).— Окраска Methylenblau. Применяются различные метиленовые синьки, например Methylenblau medicinale purissimum заграничных фирм (Hochst, Griibler), а также русского производства; обычно употребляется
1/г—1%-ный раствор или т. н. Лсф-леровская щелочная метиленовая синька, или же Boraxmethylenblau Manson'a. Препараты, фиксированные спиртом и жаром, окрашиваются до одной минуты соответственным раствором. Более тонкую окраску дает при длительной окраске сильно разведенная метиленовая синька; так например 1%-ный водный раствор Methylenblau med. pur. (5 капель на 20
см3 водопроводной воды) при окраске в продолжение одного часа полностью выявляет базофильную зернистость эритроцитов, полихромазию, а также базофилию протоплазмы и патологич. зернистость нейтрофилов. Шмидт и Шварц (Schmidt, Schwarz) окрашивают базофильную зернистость эритроцитов по Мансону; Кох (Koch)—азуром II; Телеки (Teleky)— полихромной синькой. Краски, содержащие Methylen-а z u г. После того как Романовский установил, что под влиянием действия щелочи на метиленовую синьку из нее образуется Methylenazur, способствующий получению прекрасной паноптической окраски препаратов К., было предложено много методов приготовления азур-содержащих красок. Лучшей комбинацией являются растворы азур П-эозина. Особенное распространение получила эта окраска в виде раствора Гимза. Окраска по Гимза. 1) Фиксация в абсолютном метиловом алкоголе 3 мин. 2) Окраска разведенным раствором Гимза: 15— 16 капель покупного раствора на 10
смг дестилированной воды. 3) Промыть водопроводной водой. 4) Просушить фильтровальной бумагой.'—Очень яркие препараты получаются, если по Паппенгейму (Рарреп-heim) препарат предварительно окрасить по Май-Грюнвальд, а затем раствором Гимза (фиксация метиловым спиртом опускается, т. к. он содержится в растворе Май-Грюнвальд).—Результаты окраски (см. отд. таблицу, рис. 9 и 10): ядра вишнево-фиолетового Рисунок 1—14. Красные и белые кровяные тельца крови при различных окрасках: 1.—Neutralrot-Janusgrun; 2—Brillantkresylblau; 3—модифицированная окраска по Schridde-Altmann'y; 4.—Methylviolett, тельца Heinz'a; 5—тельца Heinz'a при окраске Brillantkresylblau; 6—Triacid Ehrlich'a; 7—May-Griinwald; 8—Methylgrim-Pyronin Pappenheim-TJnna; 9—Azur II-Eosin (Giemsa); 10—базофильно-зернистые эритроциты и тельца Жолли (внизу) при окраске азур-эозином; 11—карбол-фуксин-метиленовая синька (норма); 12— карбол-фуксин-метиленовая синька (токсичность нейтрофилов); 13—оксидазная реакция; 14—пероксидазная реакция. ег—эритроцит,
пЫ—нормобласт,
тЫ—миелобласт,
п—нейтрофил, е—эозинофил,
Ь— базофил,
т—мононуклеар,
I—лимфоцит. Рисунок 15. Элементы костного мозга. 20-часовая культура гемоцитобластов из крови б-ного острой миелоидной лейкемией. Гемопоэз
in vitro: Г—гемоцитобласты; •М—митозы нейтрофильных миелоцитов;
С—сегментированный нейтрофил;
9—эрит- робласты;
Д—дегенерирующие клетки (Ценкер-формол, параф, срез, азур-эозин). Рисунок 16. Плазма нормальной крови. Рисунок 17. Сыворотка нормальной крови. Рисунок 18. Сыворотка крови при сердечном застое. Рисунок 19. Сыворотка крови при пернициозной анемии. Рисунок 20. Сыворотка крови при механической HtenTyxe. (К иллюстр. ст.
Кроветворение, Кровь.) 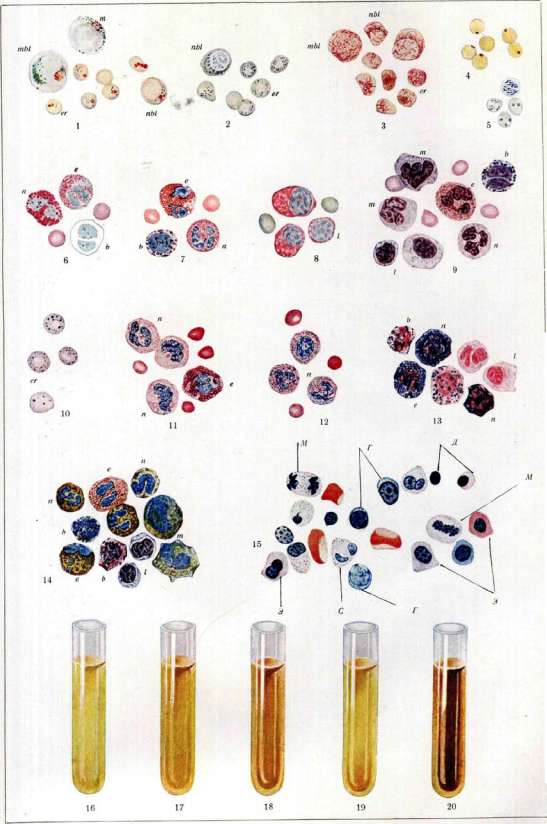
К ст, Кроветворение, Кровь.
цвета, пикнотические ядра часто голубые. Хорошо диференцируется структура ядра. Зернистость нейтрофилов—фиолетовая, зернистость эозинофилов в зависимости от колебаний рН—то яркокрасная, то несколько буроватая или синеватая. Хорошо окрашиваются азурофильная зернистость монону-клеаров и азурофильные зерна лимфоцитов (о сущности окраски см.
Гимза), к-рые благодаря эозину становятся яркокрасн. цвета (т.н. эффект Романовского). В такой же азу-рово-красныи цвет окрашивается хроматин плазмодиев малярии и трипаносом. III. Исследование в толстой капле по Россу (Ross). Для обнаружения небольшого колич. плазмодиев малярии необходимо пользоваться толстой каплей, в к-рой можно легко видеть паразитов после гемолиза эритроцитов. Приготовление препарата: на предметное стекло наносятся две капли К., к-рые размазываются платиновой иглой в виде круга приблизительно около 1
см в диаметре; затем препарат хорошо высушивается (для скорости можно положить в термостат). На нефиксированный препарат наливается обычным способом приготовленный раствор краски Гимза (или нижеописанный раствор Azur II-Eosin); через 3 мин. краска осторожно сливается легким наклонением препарата; в то же время добавляется свежий раствор краски, к-рый оставляется на 25 мин. Затем препарат осторожно смывается в горизонтальном положении де-стилированной водой, высыхает в вертикальном положении (ни в коем случае нельзя высушивать фильтровальной бумагой). Шиллинг пользуется толстой каплей для приблизительного учета количества поли-хроматофилов; последние обнаруживают ба-зофильную строму, выпавшую в виде сетки. В толстой капле определяются также эозино-филы в случаях, когда их очень мало в мазках К.— Способ Но хт a (Nocht). Можно получить вполне равноценные патентованной краске Гимза растворы азур-эозина по способу Нохта. Приготовляются два раствора: 1) 1,0 Azur II (лучше Grubler'а или Merk'а) разводится в 1.000
см3 дестилиро-ванной воды; 2) 1,0 эозина растворяется в 1.000
см3 дестилированной воды. Затем каждый раствор наливается отдельно в капельницы. Для установления правильной смеси для окраски элементов К. приготовляется несколько пробных мазков, из к-рых каждый красится несколько другой смесью, напр. на 3
см3 дест. воды берется 4 капли раствора Azur II и 4 капли раствора эозина (отношение 4 : 4) или 4 : 5, 4 : 6 и т. д. Препарат с вишнево-красными ядрами с выявленной зернистостью нейтрофилов устанавливает правильную смесь красок. Определение в нейтрофилах изменений, получающихся при различных интоксикациях, с помощью окраски азур-эозином. При различных заболеваниях (пневмония, гнойные процессы, брюшной тиф, туберкулез и др.) зернистость нейтрофилов становится более крупной и полиморфной, а в основе протоплазмы появляются голубоватые комочки (включения Dohle) наряду с исчезанием зернистости и вакуолизацией протоплазмы. Резкие измене- ния нейтрофилов можно видеть на любом препарате, хорошо окрашенном азур-эозином; для более слабых изменений можно пользоваться только краской с определенной концентрацией водородных ионов. Для этой цели Голборном (фирма Grubler) приготовляется Гимза с рН=5,4; употребляемая для разведения вода должна быть нейтральной. Реакцию воды можно установить с помощью гематоксилина: к 10
см3, дест. воды прибавить (чистым пинцетом) несколько крупинок гематоксилина; не раньше 1 мин. и не позже 5 мин. вода должна слегка окраситься в фиолетовый цвет. Если после 5 минут вода не получает этой окраски, можно прибавить каплями 1 %-ный раствор Natrii carbonici до появления правильной красочной реакции и таким образом исправить реакцию воды. Титрованным раствором Гимза пользуются Негели, Глор (Gloor) и др., тогда как Момсен (Mommsen) предложил устанавливать пат. зернистость буферным раствором при рН=5,4. При такой окраске выявляется только пат. зернистость, нормальнаяже.зернистость не окрашивается. Буферный раствор:
°-/1 едкий натр (Merk)— 21,6
см3, ид уксусная к-та (Merk)—27,0
см3, дест. вода до 1.000,0
см3 [можно получить готовым от Grubler'a (Hollborn)]. Раствор краски: раствор Гимза (Grubler)— 10
см3, дестиллир. вода — 40 ом
3,-буферный раствор—до 100
см3. Красить в продолжение 1 часа; старые препараты—до 2 часов. Смывать буферным раствором. Высушить. Пат. зернистость нейтрофилов при окраске карбол - фуксин - метиленовой синькой по Фрейфэльд. При окраске карбол-фуксин-метиленовой синькой протоплазма нормальных нейтрофилов и нейтрофильных миелоцитов лишена какой-либо зернистости (см. отд. табл., рис. 11), тогда как пат. зернистость в нейтрофилах (см. отд. табл., рис. 12) и в миелоцитах выявляется в виде фиолетово-синих зернышек и комочков различной величины и формы—от пылевидной зернистости до довольно крупной комковатости.— Способ окраски. Приготовляются два раствора: 1) 1,0 Fuchsin fur Вас. (Grubler) (основной) растворяется в 15 г 96°-ного спирта при нагревании; после того как раствор остынет, к нему прибавляется 100
см3 5%-ного раствора карболовой кислоты' (Acid. carb. cryst.); 2) 1 %-ный водный раствор Ме-thylenblau med. pur. (Grubler). На фиксированный в продолжение 3 мин. метиловым спиртом препарат наливается высоким слоем приготовленный ex tempore следующий состав: к 20
см3 водопроводной воды прибавляется 7 капель первого раствора, взбалтывается, а затем прибавляется 5 капель второго раствора и снова взбалтывается. Окраска в продолжение одного часа, после чего препарат смывается водой и высушивается фильтровальной бумагой.—Для удачной окраски необходимо, чтобы посуда была чистая, без щелочи или к-ты, а также чтобы из капельниц всегда получалась одинаковой величины капля. Капли метиленовой синьки должны быть одинаковы между собой, так же как и капли карбол-фуксина. В случае неудачной окраски, если ядра лейкоцитов получились красными, можно до- красить препарат в течение двух минут ме-тиленовой синькой (5 капель 1 %-ной метиле-новой синьки на 20
см3 водопроводной воды). Препараты, окрашенные по Гимза, хорошо' окрашиваются карбол-фуксин-метиленовой синькой (б°з предварительного раскрашивания), и наоборот. Окраска пат. зернистости нейтрофилов карбол - фуксин - метил? новой синькой безошибочна в смысле диагностики; пат. зернистость миелоцитов может быть установлена только этим способом. Окраска Carbolpyroni n-M e thyl-griin. Раствор краски (Pappenheim-Unna) можно получить готовым от Grtibler'a (Лейпциг) или же краска приготовляется из ее составных частей следующим образом: Methyl-griin 00 cryst. gelbl.—0,15 г, Pyronin—0,25, Alcohol 96 %-ный—2,5, Glycerin—20,0, Acid. carb.—0,5, Aq. dest.—100,0. Как пиронин, так и метилгрюн являются щелочными красками, причем первый окрашивает преимущественно базофильную субстанцию, а второй—хроматин ядра. Особенно интенсивно в яркокрасный цвет окрашивается протоплазма лимфоцитов и плазматических клеток (см. отд. табл., рис. 8); клетка, у которой протоплазма не окрашивается в красный цвет. безусловно не лимфоцит, но не наоборот, так как всякая клетка с базофильной протоплазмой окрашивается в такой же ярко-красный цвет, напр. эритробласт. Базофиль-ная зернистость эритроцитов также ярко-красного цвета. Ядра лимфоцитов—зеленовато-голубого цвета, ядра лейкоцитов—фиолетовые.-—Способ окраски: 1) фиксация жаром или любой фиксирующей жидкостью; 2) окраска в продолжение 5—10 мин.; 3) промывка водопроводной водой; далее, обычно. Оксидазная реакцияВинклер-Шульце (Winkler-Schultze). В протоплазме лейкоцитов, в отличие от лимфоцитов, обнаруживаются вещества по всей вероятности характера окислительного фермента окси-дазы, к-рые при воздействии нижеописанного реактива ведут к образованию индофе-нолблау. 1) Фиксирующая жидкость: 1 часть 40%-ного формальдегида+ 9 частей 95%-но-го спирта, фиксировать в продолжение нескольких секунд. 2) На фиксированный препарат наливается: а) на 3 мин. слегка разведенный 1 %-ный водный щелочный раствор a-Naphthol'a. Раствор приготовляют следующим образом: a-Naphthol при нагревании в дестилированнои воде поднимается кверху и плавает в жидком виде; в этот момент прибавляется кристалл едкой щелочи; -тогда a-Naphthol растворяется в воде; б) не смывая и не осушивая препарата, на него наливают 1 %-ный водный раствор Dimethylparaphe-nylendiamin 'а. Через несколько минут зернистость лейкоцитов становится темносиней. Докрашивается препарат сильно разведенным раствором фуксина Циля. Бблыная часть нейтрофилов дает резко положительную' реакцию, и только единичные нейтро-филы содержат мало оксидазных зерен; эози-нофилы все с положительной реакцией, тогда как базофилы дают положительную реакцию только в стадии созревания—базофиль-ные миелоциты. Часть мононуклеаров также дает положительную реакцию (см. отд. табл., рис. 13). Что касается миелобластов, то они дают положительную оксидазную реакцию только на стадии наибольшего созревания (переход в промиелоциты). Т. н. лябилъ-ная оксидазная реакция (Nadi-рёакция по Graeff'y), которая получается без предварительной фиксации после действия свободного от щрлочи раствора* a-Naphthol 'а в 1 %-ном растворе Dimethylparaphenylendi-amin'a, производится на срезах. Лимфоциты иногда дают положительную лябильную оксидазную реакцию. Пероксидазная реакция была предложена Крейбихом (Kreibich) и Фише-лем (Fischel); очень хорошо она получается по методу Грэма (Graham): фиксация жидкостью из 1 части 40%-ного формалина-f 9 частей 95°-ного спирта; затем препарат слегка промыть водой и налить на него раствор бензидинана5 минут. Последний приготовляется следующим образом: к 10
см3 40°-ного спирта прибавляется несколько кристаллов бензидина и 0,02
ем3 перекиси водорода (пипетка от гемометра Sahli); затем смыть. Обычно положительная реакция выявляется в виде золотисто-коричневых зерен, реже синеватых (первый стадий действия бензидина). Докрашивать можно тио-нином, синькой или азур-эозином. Окрашиваются только свежие препараты; окрашенные препараты долго сохраняются. Результаты окраски в общем при оксидазной и пероксидазной реакции одинаковые (см. отд. табл., рис. 14).—Предложены различные модификации пероксидазной реакции, напр. Naphthol-пероксидазная реакция (Loele); предложенная Эпштейном методика дает также хорошие результаты.—С п о с о б Э п-штейна:1) фиксация мазка К. (не старше 48 часов) смесью Alkohol (95°)—90,0, Formol (40°)—10,0; 2) промыть дестилированнои водой (15—20 сек.); 3) налить на 3 мин. раствор из: Alkohol (40°) 100,04-«-Naphthol—1,0+ +3%-ный Н
20
2:—0,2 (по Грэму); 4) промыть дестилированнои водой; 5) красить в продолжение 15 мин. (до 14 часов) в следующем растворе: Toluidinblau—l,0,Lith. citricum— 1,0, Aq. dest.—100,0; 6) быстро промыть дестилированнои водой (1 сек.); 7) промыть в 1 %-ном растворе танина (1 сек.); 8) просушить фильтровальной бумагой. Дающая пероксидазную реакцию зернистость нейтрофилов, эозинофилов и мононуклеаров окрашивается в яркозеленый цвет. Эритроциты—зеленоватые; в остальном характерная окраска азурсодержащей смеси. Выявление липоидов в зернистости лейкоцитов. 3epT(Sehrt)предложил специальный способ окраски Sudan'ом мазков К.; с помощью этой окраски выяснилось, что зернистость как нейтро-фильных, так. и эозинофильных лейкоцитов, а также мононуклеаров — суданофильная, т. е. что она дает характерную липоидную окраску. Модификация этой окраски Гольд-маном дает очень хорошие результаты; при этом Гольдман установил, что зернистость лейкоцитов, окрашивающаяся Суданом, всегда дает оксидазную реакцию.— Способ окраски. 1) Фиксация свежего мазка К. в продолжение 3 мин. раствором 1 части Formol'a (40°) и 4 частей Spirit, vim гесШм 2) промыть дестилированной водой; 3) смыть слабым спиртовым раствором (30—40°); 4) красить в течение 15 мин. следующим раствором: Spiritus 70°—100,0+ Н
20 —20,0 + + Sudan III (в избытке) + a-Naphthol 1,2 + + Н
20
2(3%)—0,3 (спиртовой раствор Судана и a-Naphthol'a кипятится в продолжение 5 минут; к остывшему раствору прибавляется перекись водорода); 5) промыть дестилированной водой; затем автор окрашивает ядра 1—3 мин. гематоксилином Вбп-mer'a (5 капель гематоксилина+2—3 капли Liq. ferri sesquichlorati). Лучшую окраску ядер дает гематоксилин Кароцци (Carozzi) [0,25
г крист. гематоксилина+0,025 йодноватого калия (КJ0
3) +1,0 калийных квасцов+25,0 глицерина + 100,0 дестил. воды]. Результаты -окраски: зернистость нейтрофи-лов, эозинофилов и мононуклеаров—ярко-оранжево-красного цвета. —Гистогенетиче-ское изучение форменных элементов К. производится гл. обр. на эмбриологическом материале и экспериментальным путем. Краски для срезов из тканей и органов применяют те же, что и для мазков, соответственно приспособляя их кгист.технике. В последнее время развитие кровяных клеток изучается также методом тканевых культур. Е. Фрейфельд.
VІІІ. Физико-химические свойства крови. К. представляет клейкую непрозрачную жидкость красного цвета, солоноватого вкуса. Уд. в. К. равен 1.050—1.060; по Бамбер-геру (Bamberger), для мужчин—в среднем 1.057,5, для женщин—1.053; по Шмальцу— 1.059, resp. 1.055. Зависит уд. вес гл. обр. от количества эритроцитов или НЬ, менее—от свойств сыворотки. Уд. в. эритроцитов— 1.090, сыворотки—1.028—1.032, плазмы— 1.029—1.034. Уд. в. сыворотки определяется гл. обр. содержанием белков, т. к. процентное их содержание значительно превышает содержание др. плотных веществ сыворотки (мочевины, сахара, NaCl). Колебания в содержании сахара, мочевины, желчных пигментов, жира даже при пат. условиях не могут существенно изменить уд. вес сыворотки.—В физиол. условиях повышение уд. в. крови наблюдается при сильных физич. напряжениях, под влиянием действия жара, при отнятии жидкостей. Эти изменения однако скоро выравниваются. Утром уд. в. К. несколько выше, чем во вторую половину дня. В патологии сгущение крови с соответствующим повышением уд. в. описано при раке пищевода и привратника (до 1.070), при долго длящихся поносах (при холере, дизентерии—до 1.080), при тяжелых ожогах (до 1.073). При холере определение уд. веса К. имеет, по Роджерсу, значение в том отношении, что повышение до 1.063 представляет показание для внутривенных вливаний. Менее значительные повышения уд. в. сопутствуют эритроцитозам при врожденных пороках, декомпенсации пороков сердца. Понижение уд. в. крови характерно для обеднения К. форменными элементами, следовательно для анемий, при к-рых уд. в. падает до 1.040 и ниже, приближаясь к нормальному уд. весу сыворотки; понижение уд. в. сыворотки наблюдается при обеднении ее белками на почве почечных и кахектических отеков. В общем в современной клинике в большинстве случаев определение уд. веса К. и сыворотки заменяется счетом эритроцитов, определением НЬ и рефрактометрией сыворотки, дающими более прямой ответ на те главные изменения состава К., к-рые преимущественно влияют на колебания уд. веса. Техника определения удельного веса. При пикнометрическомметоде Шмальца (Schmaltz) набирают кровь (около 0,1) в химически чистый особый капиляр, взвешивают й затем определяют в этом же капиляре вес точно такого же объема дестилированной воды. Ареометрический метод Гаммершлага (Hammerschlag) состоит в том, что крови дают по каплям падать в жидкость, уд. вес к-рой приблизительно соответствует К. (смесь хлороформа уд. веса 1.485 и бензола уд. в. 0,88), наблюдают, падает ли.или тонет капля в этой смеси, несоответственно добавляя того или другого ингредиента, получают смесь, в к-роЙ новая капля К. остается взвешенной; определяют ареометром уд. в. этой смеси, показывающий и уд. в. исследуемой крови. Роджерс (Rogers) ускоряет определение, приготовляя серию смесей глицерина с водой с уд. в. от 1.040 до 1.070. Помещая капли К. в отдельные смеси, легко подбирают уд. в. крови. Барбор и Гамильтон (Barbour, Hamilton) определяют и уд. в. крови, как и др. жидкостей, по времени падения капли испытуемой жидкости через определенный слой смеси ксилола и бром-бензола по сравнению с временем падения стандартных растворов K
2S0
4. E. Тареев. Вязкость К. зависит от 1) вязкости плазмы, 2) количества эритроцитов и их объема, 3) содержания НЬ, 4) количества С0
2 в крови, 5) солевого состава плазмы и др. условий. Особенно тесная зависимость отмечается между объемом эритроцитов и вязкостью К. По Фрею (Frey), объем эритроцитов в объемных процентах=2,4
п2, где
п—величина вязкости (см.
Вязкость, Вискозиметрия) .—П оверхностное натяжение К. как цельной, так и дефибринированной меньше поверхностного натяжения воды. Различие между поверхностным натяжением К., плазмы и сыворотки очень незначительно. С понижением t° поверхностное натяжение увеличивается. При определении поверхностного натяжения сыворотки сначала получают величины более высокие, чем при повторных определениях. Спустя приблизительно полчаса после первого определения, получают наименьшую величину. Наибольшая величина называется динамическим поверхностным натяжением,наименьшая— статическим. Для нормальной сыворотки человека величина статического поверхностного натяжения=58—57 дин/ом при 16—18° и 47 дин/см при 37°. Поверхностное натяжение К. при патолог, состояниях претерпевает, значительные изменения: оно уменьшается при эклямпсии, уремии, при сердечно-сосудистых заболеваниях, при содержании в К. желчнокислых солей, при повышении содержания СО
2 в крови и т. д. Увеличение поверхностного натяжения встречается значительно реже. Отмечено, что поверхностное натяжение сыворотки, дающей положительную RW, повышено. Приведен- ные данные об изменении поверхностного натяжения крови не могут считаться однако твердо установленными и требуют проверки. Осмотическое давление сыворотки и дефибринированной К. одинаково и представляет в норме весьма постоянную величину. Максимальные колебания в фи-зиологич. условиях соответствуют
А —0,54— 0,59°, в среднем—0,56°, в грамм-молекулах осмотической концентрации сыворотки =
= т^ = гИ!
= 0,3 грамм-молекулы. В раз-личных участках кровеносной системы
Л К. может иметь различную величину; напр. в v. portae
Л =0,692—0',602°; в vv. hepaticae
Л = 0,722—0,633°; С0
2повышает
Л. Главное место в осмотической концентрации К. принадлежит кристаллоидам, в первую очередь NaCl (около 60%). На долю белков сыворотки приходится всего 0,01° величины
Л. При беременности
Л уменьшается, составляя в среднем 0,54°, при различных формах нефрита повышается до 0,60—0,71°. Из составных, частей сыворотки главное значение для электропроводности, так же как и для осмотического давления, имеет NaCl, содержание к-рого в сыворотке обусловливает около 63% общей величины электропроводности; из оставшихся 37% большая часть приходится на долю бикарбонатов. Электропроводность сыворотки довольно постоянна и изменяется значительно только в пат. случаях. Изменение содержания СО а в крови не отражается на величине электропроводности сыворотки, что объясняется сложными процессами обмена ионами между эритроцитами и плазмой при изменении содержания С0
2 в К. (см. ниже). О физиол. влияниях на электропроводность сыворотки известно мало: мышечная работа повидимому повышает электропроводность сыворотки, влияние питания остается еще невыясненным. Беременность не изменяет электропроводности. Электропроводность плазмы и сыворотки одинакова. Электропроводность К. значительно меньше, чем сыворотки, так как способность форменных элементов проводить ток ничтожна. Животные А. 10-* Плазма А. 10-* Кровь А. ю~* Кашица формен. элементов 105,3 103,7 112,9 107,4 63,4 62,8 36,9 43,3 1,63 1,67 1,70 2,17 Существовавшее одно время мнение, что электропроводность кровяных телец может быть принята равной 0, оказалось ошибочным: косвенным способом Геберу (НбЬег) удалось показать,что электропроводность эн-доглобулярного содержимого эритроцитов соответствует содержанию NaCl в растворе в количестве 0,2%. Определение электропроводности дает представление об общей сумме ионов. В настоящее время предложены также методы для определения концентрации отдельных видов ионов.—Метод определения ионной концентрации щелочных металлов основан на общем принципе концентрационных элементов (см.
Газовая цепь), и особенность его заключается лишь в приготовлении соответствующих электродов. Михаелис (Michae-lis) пользуется электродами из амальгамы щелочных металлов, сохраняющейся без доступа воздуха в специальном сосуде, дающем возможность по мере надобности обновлять поверхность электрода, окисляющуюся на воздухе. П р и г о т о в'л ение электрода: в сосуд А (рис. 3) помещается около 200 си
3 чистой и сухой ртути; вырезав сверлом для пробок несколько кусков (около 5
г) Na или К, их быстро переводят в трубку
а. Несколько раз эвакуируют сосуд
А, наполняют его водородом, запаивают свободный конец трубки
а, слегка ее подогревают, давая стечь расплавившемуся металлу в ртуть, и запаивают капиляр
К. Переболтав содержимое сосуда
А, соединяют каучуком трубки
Ь и
d, эвакуируют сосуд
В через ход
Е, открывают кран Я и дают стечь амальгаме в резервуар
В; оставшуюся свободной часть резервуара
В через кран Н, наполняют водородом. Поворотом крана H
s наполняют амальгамой трубку
I, служащую электродом. При определении, погрузив электрод в жидкость, последнюю соединяют при помощи трубки, наполненной агаром с хлористым калием, с насыщенным раствором КС1, куда опущен носик каломельного полуэлемента. (Рис.—см. на ст. 675—676). Большое распространение получил метод определения в К. или плазме концентрации водородных ионов. Предложены три различных метода: 1) электрометрический (см.
Газовая цепь, Активная реакция), 2) колориметрический (см.
Индикаторный метод), 3) газоаналитический.—1. Единственно правильным методом электромет-рич. определения концентрации Н-ионов крови Бигвуд (Bigwood) счита
т исследование плазмы, отделенной от форменных элементов при том давлении 0
2иС0
2, к-рое было в крови. При точной работе перед каждым определением электроды должны быть заново отплатинированы. 2. Колориметрический метод определения активной реакции плазмы по Куллену (Cullen). Необходимые реактивы: 1) Стандартные растворы фосфатов, приготовленные согласно таблице. т/15 т/15 т/15 т/15 рН Na
2HP0
4 рН Na
2HP0
4 КН
гР0
4 см* CJltf см»
см' 7,00 61,1 38,9 7,45 82,5 17,5 7,05 63,9 36,1 7,50 84,1 15,9 7,10 66,6 33,4 7,55 85,7 14,3 7,15 69,2 30,8 7,60 87,0 13,0 7,20 72,0 28,0 7,65 88,2 11,8 7,25 74,4 25,6 7,70 89,4 10,6 7,30 76,8 23,2 7,75 90,5 9,5 7,35 78,9 21,1 7,80 91,5 8,5 7,40 80,8 19,2 2) Раствор индикатора: в мерительной колбе емкостью в 100
см3 к 95
см3 0,9%-ного раствора NaCl прибавляется 1,05 ом
3 0,04%-ного раствора фзнолрота и несколько капель 00,2 n NaOH до рН = 7,4—7,6; колба дополняется раствором NaCl до метки.—X о д определения: к 5—20
см3 раствора № 2 в пробирках с плоским дном добавляется парафиновое масло, под слой к-рого выпускается 0,4—1,0
см3 плазмы. Размешав содержимое пробирки, сравнивают полученную окраску с окраской стандартного раствора + индикатор в компараторе Уолпола; рН дляt°38° вычисляется по ф-ле: рН
38=рН, найденному при темпер, опыта,+0,01 (t
c-20°) — 0,23; температуру, при которой производилось определение, измеряют, погружая термометр в пробирку с разведенной плаз- мой. 3. Газоаналитический способ определения рН крови, предложенный Га-сельбальхом (Hasselbalch), основан на следующих положениях. Активная реакция К. обладает значительным постоянством, к-рое обусловлено 1) особенностями ее хим. состава (см.
Буферные свойства крови) и 2) рядом физиол. процессов (дыхание, работа почек, желез пищеварительного тракта и т. д.). Из минеральных составных частей К. буферным действием обладают бикарбонаты (NaHC0
3 + C0
2) и фосфаты (Na
2HP0
4 + +NaH
aP0
4); значение последних однако лишь второстепенное, т.к. концентрация их в К. очень мала (около 3 миллимоль). Для СО
2 в присутствии в растворе бикарбонатов действительно уравнение: '[СО,] ' где [Н']—концентрация ионов Н, [Bic]—концентрация соли NaHC0
3; [C0
2]—концентрация угольной к-ты, а—степень диссоциации бикарбоната при данной
\°;К—первая константа диссоциации углекислоты. Вводя вместо
К обозначение 10~~Р
г и логарифмируя, получаем: -pH+log^ + loga — p,, где
рН = - log [И*]; отсюда: pfl«p
fa + logg£j.....
(1), где
Vh = р
л + log a . В норме отклонения
рКх от средних величин (6,10 при 38°; 6,18 при 20°) не превосхо-дят±0,03. Достаточно следовательно найти концентрацию С0
2, находящейся в плазме в состоянии растворения [С0
2], и концентрацию бикарбонатов [Bic], т. е. значение дроби
\т^~\, чтобы обладать всеми L^o
2J
данными для вычисления рН. В определении величины дроби Lic": и заключается газоаналитический метод определения
рН. Количество свободной С0
2 в плазме зависит 1) от напряжения угольной к-ты в К. и 2) от коефициента растворимости (см.
Газы крови). В объемных процентах количество растворенной СО
а равно ™^--0,1316
pa.....(2), где
р—давление С0
2; a—коефициент растворимости.—Концентрацию бикарбонатов, выражая ее в объемных % С0
2, находят, вычитая из найденного общего количества угольной к-ты ту часть ее, к-рая находится в состоянии растворения: [Bic.]—С0
2—0,1316
ра... (3). О величине произведения 0,1316 a при различной t° можно судить по таблице. Темп. По Бору (Bohr) По Ван-Слайку и Мак-Лину 15° 20° 25° 30° 38° 0,1307 0,1128 0,0975 0,0855 0,0712 0,1225 0,1057 0,0913 0,0800 0,0668 При работе не с плазмой, а с К., в величину а сыворотки нужно внести поправку, зависящую от количества 0
2 в крови: а для кро-ви=(1—0,00677i) a сыворотки, где
h—количество 0
2 в объемных
% (v%). Подставив выражения (2) и(3) в уравнение (1), получим: Так. обр. для вычисления рН достаточно знать давление С0
2 в К. и общее количество С0
2 плазмы, выраженное в
v%.—Давление С0
2 в К. можно определить несколькими способами.
1. Прямой метод предложен Крогом (Krogh) и заключается в том, что маленький сосудик емкостью около 2
см3 (микротонометр; рис. 4) наполняется доверху К. через загнутый конец (в качестве веществ, препятствующих свертыванию крови, применяют гирудин, гепарин, Na
2C
20
4, NaF) и запирается сверху входящим в каучук термометром, имеющим на конце чашечку. Чашечка увлекает с собой пузырек воздуха, к-рый перебалтывается с кровью при t° 38° для выравнивания давления газов, а затем переводитсяв микроаппарат Крога (рис. 5), предварительно наполненный подкисленным физиол. раствором. Существенную часть аппарата для анализа газов составляет градуированный узкий стеклянный капиляр, внизу заканчивающийся небольшой воронкой и имеющий боковой ход, закрытый винтом. Оставив после перебалтывания пузырек
р около загнутого конца, последний вводят в наполненную физиол. раствором воронку (1) микроаппарата. Вдвигая термометр вглубь тонометра, выгоняют пузырек
р из тонометра и переводят его в воронку (1). В дальнейшем поворотами винта S пузырек р насасывается в капиляр, где измеряется его объем при определенной t°; после этого, поставив аппарат в наклонное положение, отсасывают физиол. раствор из воронки и заменяют 10%-нымраствором едкой щелочи. Аппарат вновь ставится в вертикальное положение, и поворотами винта S пузырек осторожно приводят в соприкосновение со щелочью; следя за тем, чтобы щелочь не затекла в капиляр, вращают винт
h и передвигают пузырек вверх и вниз для лучшего поглощения С0
2. Оставив пузырек в нижней части капи-ляра, отсасывают щелочь, заменяют ее физиологич. раствором и, вновь насасывая пузырек в капиляр, измеряют его объем. Разность между 1-м и 2-м отсчетом после поправки на t° дает количество содержавшейся в пузырьке СО». Зная первоначальный объем пузырька (1-й отсчет), вычисляют процентное содержание в нем С0
2, а зная атмосферное давление, вычисляют парциальное давление СО*. Точность анализа зависит гл. обр. от чистоты капиляра. Косвенно определить напряжение С0
2 в К. можно следующим образом: в пробе К.,взятой с необходимыми для анализа газов предосторожностями, определяют общее количество CO
s или выкачиванием (см. Газы
крови), или в аппарате Баркрофта (см.
Барп-рофта аппарат), или по методам Ван-Слайка (см.
Ван-Слайпа методы). Затем несколько проб К. (обычно три) насыщают газовыми смесями, содержащими различное количество С0
2. В крови, насыщенной газовой смесью того или другого состава, определяют тем же методом, что и раньше, общее количество СО
г и полученные в
v % данные изображают графически, откладывая найденные величины по оси ординат. Определяют также давление С0
2 в газовых смесях, к-рыми производилось насыщение (выражая давление С0
2 в
мм столба ртути), и наносят полученные данные на абсциссу. Соединив расположившиеся в системе координат точки, получают кривую связывания кровью СО
г при различных давлениях последней.—Пример анализа артериальной крови: общее количество С0
2 в К. без предварительного насыщения—50»%; общее количество С0
2 после насыщения: при парц. давлении С0
2—31
мм—45,5»%, при парц. давлении С0
2—38,5
мм—49,0»%, при парц. давлении С0
2— 45,0
мм—52,8»%.—Графическое изображение полу-ченя х результатов дает кривая
ab (рис. 6). Если из точки кривой, соответствующей найденному без предварительного насыщения общему количеству С0
2, опустить перпендикуляр на абсциссу, то место пересечения этих двух прямых укажет давление СО», бывшее в К. (40
мм). Нек-рые затруднения возникают при определении этим методом давления С0
2 в венозной К. Кровь, содержащая восстановленный НЬ, связывает больше С0
2, чем окисленная (на 5—6
v%); кривая связывания Темп. По Бору (Bohr) По Ван-Слайку и Мак-Лину 15° 20° 25° 30° 38° 0,1307 0,1128 0,0975 0,0855 0,0712 0,1225 0,1057 0,0913 0,0800 0,0668 СО
2 первой лежит выше, чем второй (рис. 7). Чтобы перейти к кривой связывания С0
2 насыщенной кислородом кровью и кривой, характерной для венозной К. (ввести поправку на вецозность), следует на каждый недостающий до полного насыщения объемный процент 0
2 повышать кривую связывания С0
2, по одним исследователям на 0,34v %, по другим—на 0,27v%, в среднем на 0,3г>%. Введя соответствующую поправку, по кривым связывания С0
2 и общему количеству С0
2 можно определить напряжение С0
2 в венозной К. Более сложным способом является насыщение газовой смесью, содержащей кислород, под давлением, соответствующим напряжению этого газа в исследуемой венозной К.—О давлении С0
2 в К. можно судить также по анализу альвеолярного воздуха. Считается, что данные анализа альвеолярного воздуха по методу Гол-дейна (Haldane) соответствуют напряжению С0
2 в артериальной К., а по методу Плеша (Plesch)—в венозной. С уверенностью анализы альвеолярного воздуха стали применять для суждения о давлении С0
2 в К. после провзрки получ
снных данных непосредственным определением по Крогу. Определив каким-либо способом напряжение С0
2 в К. и пользуясь формулой (2), вычисляют количество растворенной в плазме С0
2 в
v%. В приведенном примере
v% СО
2=0,1316а.40. Чтобы найти количество С0
2, находящееся в связанном состоянии, т. е. член [Bic.j, следует из общего количества С0
2, найденного в плазме без предварительного насыщения, вычесть количество растворенной в плазме С0
2. Рекомендуют также определять кривую связывания С0
2 не цельной К., а плазмы; для выяснения напряжения С0
2 это безразлично, лишь в одном случае на кривой связывания отыскивается точка, соответствующая общему количеству С0
2 в К., в другом—в плазме. При определении кривых связывания С0
2 плазмой необходимо насыщать газовой смесью цельную К., затем,предохранив К.от соприкосновения своз-духом при помощи слоя парафинового масла, ее центрифугируют и берут для анализа плазму (истинная плазма). Если количество С0
2, находящееся в растворенном состоянии в К., вычислить для различных давлений СО
2 и полученные значения изобразить графически, то получится прямая, начинающаяся у
О системы координат и идущая под небольшим углом к оси абсцисс (затушеванный на рис. 6 и 7 угол
doc изображает количество растворенной С0
2 при различных давлениях). Расстояние от точек кривой
аЪ (рис. 6) до соответственно в отношении абсциссы расположенных точек прямой ой (напр.
h) дает выражение (в
v %) количества СО
2, находящейся в связанном состоянии. Величина
h, соответствующая давлению С0
2, равная 40
мм, называется
резервной щелочностью К. (см.). Если концентрация водородных ионов К. определяется при давлении С0
2, равном 40
мм, то полученный водородный показатель называется редуцированным рН; водородный показатель, вычисленный соответственно тому давлению С0
2, к-рое было найдено в К., называется регулированным рН. Наиболее простой метод определения кривой связывания К. или плазмой угольной к-ты предложен Фридериче (Fridericia). Центрифужная пробирка
а (рис. 8), содержащая 7—10 ом
3 К., предохраненной от свертывания добавлением Na
2C
20
4 +NaF, присоединяется на каучуковой трубке, снабженной винтовым зажимом
С, к цилиндру
В (емкость около 500
см'), закрытому пробкой с проходящей через нее капилярной трубкой с краном
D; зажим С завинчивают. Цилиндр помещают в термостат и эвакуируют водоструйным насосом, пока ртуть не поднимется в манометрич. трубке
Е до нек-рого оп-ределенн.уровня (напр. 660
мм). Тогда поворотом трехходового крана
F цилиндр
В соединяют с газометром, наполненным чистой С0
2, или с Кшшовским аппаратом и медленно напускают в
В С0
2, контролируя количество последней по падению ртути в трубке
Е. Когда давление упало на желаемую величину (напр. до 630
мм), поворотом крана
F разобщают газометр и цилиндр
В; повернув кран
Н, сообщают
В с атмосферным воздухом для выравнивания давления. Закрыв кран
D, освобождают баллон
В от системы трубок; сняв каучук
т, развинчивают зажим С; поворачивают баллон в горизонтальное положение и дают К. растечься по стенкам цилиндра. Вращением баллона
о течение 9 мин. насыщают К. газовой смесью, затем переводят баллон в вертикальное положение, давая К. стечь в пробирку. Завинчивают зажим Сив зависимости от того, анализируют ли К. или плазму, либо перерезают каучук ниже винтового зажима и немедленно набирают К. для анализа (напр. в аппарате Баркрофта) либо перерезают каучук выше зажима С и развинчивают зажим, предварительно налив в отрезок каучука выше С парафинового масла. Пробирку центрифугируют и собравшуюся над форменными элементами и под маслом плазму берут для исследования. При анализе К. в пробирку
а достаточно брать 2—2,5
см3 К. Вводя в цилиндр
В различное количество С0
2, насыщение повторяют с новыми порциями К. несколько раз и согласно указанному выше получают несколько точек кривой связывания угольной к-ты кровью или плазмой. Метод определения кривой связывания, СО
2, предложенный Штраубом (Straub) рассчитан на последуютций анализ крови в аппарате Баркрофта. В тонометр О (емкостью в 250—300
cms) при закрытом кране
В (рис. 9) помещают 2—3
см3 К., < после чего верхнее отверстие тонометра закрывают пробкой. Под давлением из специальной бюретки
А в тонометр напускают нужное количество С0
2, кран
В закрывают, тонометр помещают в термостат (t° 37—38°), где перебалтыванием кровь насыщается газовой смесью. Спустя 10 мин., соединив тонометр через кран JS с ртутным манометром, определяют, насколько давление внутри тонометра выше атмосферного. Затем дают К. собраться в части
А и, повернув кран
В на соединение с пипеткой
ЕС, дают последней наполниться К. Поворотом крана
В на соединение с
д К. выпускают под аммиачный раствор в сосудик аппарата Баркрофта. Для анализа газовой смеси тонометр соединяют с аппаратом Голдей-на для анализа газов, в к-рый насасывают нужную порцию и анализируют.—Пример вычисления давления С0
2 в тонометре: давление в тонометре повышено на 60
мм; коррегированное показание барометра = = 760
мм. Суммарное давление в тонометре 760 +60 = = 820; за вычетом давления водяных паров (47
мм) = = 773
мм. Найденное в газовой смеси содержание С0
2 = 773 0 3 = 0,3%; откуда давление С0
2 = — --
' ' = 2,32jvuiHg. Метод Штрауба не имеет преимущества перед методом Фридериче, т. к. при последнем для большей точности работы можно определять давление газовой смеси в тонометре и вторично контролировать давление СО
2, анализируя газовую смесь в аппарате Голдейна. —При определении активной реакции К. следует соблюдать ряд предосторожностей при взятии К. и сохранении ее до анализа: К., взятую без всякого зажатия сосуда в шприц под парафиновое масло, переводят либо через иглу, либо (сняв иглу) через каучуковую трубку в содержащую 3— 5
см3 парафинового масла пробирку, по стенкам к-рой предварительно растерта смесь NaC
20
4 + NaF. Количество смеси щавелево-
«73 кислого и фтористого натрия (1 : 1), мелко растертых в агатовой ступке, должно составлять 0,2—0,3% того количества К., которое предполагается набрать. Перемешав К. оплавленной стеклянной палочкой, пробирку ставят в снег. Если с момента взятия крови, до анализа должно'пройти некоторое время, желательно пробирку, в которой под слоем масла находится К., закрыть пробкой с отверстием для выхода масла. Это отверстие закрывается стеклянной палочкой, когда пробка вдвинута на надлежащую глубину. В таком виде К. может храниться 5—6 часов. При исследовании плазмы закрытую, как описано, пробирку центрифугируют и, открыв осторожно пробку, собирают плазму из-под масла. Возвращаясь к вопросу о стойкости активной реакции крови, следует указать на то, что растворы двууглекислых щелочных солей в присутствии свободной С0
2 легче изменяют присущую им концентрацию водородных ионов, чем плазма, последняя же легче, чем кровь. Наиболее выраженными буферными свойствами обладает взвесь красных кровяных телец. Исследуемые Давление С0
2 Р азличие объекты 20
мм 40
мм NaHCO,..... Сыворотка .... Кашица форменн. элементов крови
! 7,64 ' 7,37 7,46 ! 7,27 7,15 I 7,04 0,30 0,27 0,19 0,11 Данные таблицы указывают, что бикарбонаты являются не единственной буферной системой К. Значительно большее значение имеет НЬ. Значение НЬ как буфера становится ясным при сравнении кривых связывания С0
2: 1) раствором NaHC0
3, 2) сывороткой, отделенной от форменных элементов при давлении СО
2=44,55
мм Hg, 3) плазмой, насыщавшейся газовой смесью вместе с эритроцитами (истинная плазма), и 4) кровью (рис. 10). Оказывается, что сыворотка, отделенная от эритроцитов, обладает совершенно иной способностью связывать С0
2,чем истинная плазма и К. Кривая
III пересекает кривую II только в одном месте, именно—соответственно тому давлению С0
2, при к-ром сыворотка была отделена от эритроцитов. Кривая
III идет аналогично IV. Это объясняется тем, что при увеличении давления СО
2 в крови происходит движение анионов '(С1) в форменные элементы, за счет чего увеличивается способность плазмы связывать СО
а. Этот процесс движения ионов соответствует правилу равновесия' Доннана (см.
Допнана равновесие), причем НЬ играет роль неспособного проникать через перепонку иона. В наст, время можно считать доказанным, что и белки сыворотки "обладают буферным действием: способность ультрафильтрата сыворотки связывать С0
2 оказалась значительно меньшей, чем непрошедшей через фильтр части сыворотки, т. е. обогащенной белками (рис. 11).—Постоянство актйв-шой реакции К. поддерживается рядом фи-■зиологич. процессов, из которых на первом месте должно быть поставлено дыхание. Ма- лейшее увеличение напряжения С0
2 в крови, приводящее к сдвигу активной реакции крови в кислую сторону, вызывает увеличение легочной вентиляции, уменьшение следовательно давления С0
2 и возвращение рН К. к первоначальному уровню. В ф и з и о л. условиях изменения активной реакции К. незначительны и колеблются у разных лиц в узких пределах: 7,30— 7,44 при 38°. При пат. состояниях концентрация водородных ионов может меняться довольно значительно. Изменение рН в кислую сторону получило название
ацидоза (см.), в щелочную—
алкалоза (см.). Термины эти неудовлетворительны, так как во-первых активная реакция К. не отражает в достаточной мере состояния общбго кислотно-щелочного хозяйства организма; во-вторых неоднократно наблюдается избыточное накопление продуктов кислой реакции в К.' (напр. молочной кислоты), сопровождаемое сдвигом рН в щелочную сторону. Следует иметь в виду, что активная реакция К. зависит от самых разнообразных факторов: качественного и количественного составов электролитов К., количества белка плазмы, числа форменных элементов, концентрации НЬ, давления 0
2 и С0
2 и других условий. Более или менее правильную оценку кислотно-щелочного хозяйства крови можно сделать, лишь определив рН крови, способность связывать СО
2, концентрацию НЬ и общее количество оснований плазмы. Ван-Слайк считает достаточным определять общее количество С0
2 К. и активную реакцию. Различные изменения Кислотно-щелочного хозяйства крови Ван-Слайк изображает схемой, приведенной на рис. 12 и 13. Обозначение к рис. 12: I—декомпенсированный избыток щелочи; II и III—декомпенсированный дефицит С0
2; IV—компенсированный избыток щелочи или С0
2; V—нормальное кислотно-щелочное равновесие; VI—компенсированный дефицит щелочи или С0
2; VII и VIII—декомпенсированный избыток СО,; IX—декомпенсированный дефицит щелочи. Для оценки сдвигов активной реакции К. Гендерсон (Henderson) предлагает следующие термины: рН не выходит за пределы нормальных колебаний—euhydria; рН понижено—hyperhydria, повышено—hypo-hydria.—Г азы К.—см.
Газы крови и
Дыхание (газообмен в легких).
С. Северин.
ІX. Химический состав К. Химич. состав К. представляет собой несмотря на беспрерывный приток и отток из нее различного рода газообразных,, минеральных и органических веществ сравнительно постоянную величину. Постоянство нек-рых хим. ингредиентов К. организм поддерживает с исключительным упорством—т. н. х и м. к о н с т а н т ы К. К таким константам можно отнести: активную реакцию К. (ее рН), точку ее замерзания (A, resp. количество растворенных в ней молекул), соотношение между отдельными катионами и ряд других. В физиол. условиях незначите льные колебания химического состава крови чрезвычайно быстро выравниваются организмом самыми разнообразными путями (дыхательные и выделительные органы и проч.). Нижеследующая таблица дает представление о тех узких пределах, в к-рых колеблется нормальный химич. состав крови.
i _—L— ii-- iO
^-— ^r" IV j
*0 !// 10-W— 1 -------1------- 10 20 30 40 50 60 70 80 90 10O давление СОг в
мм Hg 10 поглотительная р©н© ©
S3
для сводив, с атмосф. возд к газометру
10 20 30 40 50 60 70 80 90 100 ПО
давление СОд б
mm Hg
> о |0 рН-13
, > > f° а О 40
я30 h
|^о mm га d
$ 0 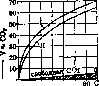
давление С02 в .«.« Не в
6 10 20 30 40 50 —. давление СОа в
мм Hg 7
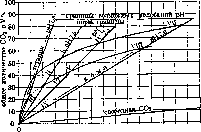
10 20 30 40 50 60-70 80 90 100 110120180140 1 давление СОг в мм Hg ^
Нормальный состав крови человека (по данным различных авторов). Объем и состав- I ные части
.Кровь Плазма Эритроциты Объем..... Вода....... Сухой остаток . . Гемоглобин . . . Белок (общин) . Фибриноген . . . Глобулины . . . Альбумины . . . Остаточный азот ; Мочевина .... j Мочевая к-та . .
1 Креатин..... I Креатинин.... Азот аминокислот | Индикан ... j Аммиак ..... j Сахар ...... Молочная к-та . | Общее количество I жирных к-т . . ; Нейтральный жир Лецитин ..... : Холестерин . . . 75—85
г % о—15 » »
0—17 » » -54 % -91
г с - 9 » 6,4—8,3 2% 0,1—0,4 » > 2,8—3,1 » > — J4,0—4,5 » >: 19—45
мг% 118—40
мг °4 13—30 » »|20—36 » » 0 7—4,0 » »;'
— 6,2—7,5» »!
— 1—2 » »i
— 4,7—8,0 » »
— 0,025—0,0821
— 0,02—0.03 |
— 79—116 » »
!98—
Шмг°/( 11—30 » »:
— —
250—470 » > — 200—400 » > 220—450 »
»! 170—260 » > 160—220»
»|120—2-J0 »»'' -46 % -68
г -32 -41 —68
г % 17—: 55
мг° 28 » f Объем и составные части Кровь Плазма Эритроциты Билирубин . . Общее кол-во оснований . . . Натрий.....
; 170-220
мг% Калий......'150—200 »
» Кальции.....15,3—8,9 »» Магний.....2,3—4,0 » » !ioo-121jh3% 300—470 » -480 » -240
» Железо Хлор....... Фосфор (общ.) . . Фосфор, растворенный в к-тах Фосфор неорганический . . Фосфор липоид-ный...... Фосфор остаточный ...... Сера неорганическая...... Сера (о'бщая) . . Иод....... 50—60 » » 270—320 » » 53 » » -6,0 0,25—
1,0мг% 0,140—0,150 мол. 280—350
мг% 16—24 » » 9—13 » » 1,6—3,5 » » следы 340—380 » » 7,4—1,3 » » 2,4—4,5
» » 1,9—4,4
» » 5,1—9,2
» « -1,3
»> » 47—160 310—360
мг %
» » —
0,1- 0,5—1,1 » »0,5—0,9
1 —
' 10—20 » » 0,002-0,013»
— 100—200 150—190 58—101 44—79 3,1—8,6 13,8—19 38,9—75
» » » » ,8 » » ,8
» » * Из этого количества около 60% в виде эстеров. Белки. Белки кровяной плазмы составляют около 6—8% плазмы или около
3Д сухого остатка ее; почти эти же отношения имеют место и для сыворотки; по отношению к цельной К. белки плазмы составляют 3—4%. Главными белками кровяной плазмы являются глобулины и альбумины. В этих основных группах можно различать б. или м. обособленные подгруппы. К числу глобулинов кровяной плазмы принадлежат: 1. Фибриноген, отличающийся относительно малой степенью дисперсности, низкими границами высаливания [из пятикратно разбавленной плазмы выпадает при 13—28% насыщения (NH
4)
2S0
4], низкой t° коагуляции (56°), способностью переходить в фибрин (при свертывании крови). Фибриноген составляет 0,1—0,4% плазмы. В пат. случаях, в особенности при б-нях, протекающих с лейкоцитозом (за исключением лейкемии), содержание его может повышаться (гиперинозия) до 1,5%; при малярии, пернициозыой анемии, лейкемии и при некоторых др. заболеваниях наблюдается уменьшение содержания фибриногена (гипинозия), доходящее даже (очень редкие случаи) до полного его исчезновения. По своему отношению к свертыванию К. фибриноген имеет весьма важное биол. значение .2.Фибрин-глобулин, также обладающий низкими границами высаливания и низкой t° коагуляции, но остающийся в сыворотке после выделения фибрина; количество его невелико; одни авторы считают, что он преформирован в плазме, другие,-—что он образуется в момент свертывания фибриногена. 3. Параглобулин (2—3% плазмы), представляющий смесь глобулинов, которая школой Гофмейстера (Hofmeister) была разделена при помощи дробного осаждения солями на две главные фракции: а) э й г л о б у л и н, высаливающийся при 28—36% насыщения (NH
4)
2S0
4 и находящийся в плазме в растворе благодаря действию защитных коллоидов, и б) п с е в-доглобулин, высаливающийся при 33—46% насыщения(NH
4)
2S0
4. Наложение друг на друга границ высаливания вызывает сомнение в индивидуальности этих фракций.— Сывороточный альбумин (4—6 % плазмы) также повидимому не представляет однородного вещества, за что говорят непостоянная t° коагуляции, различные границы высаливания и различные формы кристаллов. Были попытки разделить группу альбуминов на различные фракции, например растворимые и нерастворимые в воде (псевдо- и эйальбумины). Темп, свертывания сывороточного альбумина (70—85°) сильно зависит от содержания солей. Сывороточный альбумин может быть получен в кристаллическом виде (см.
Белки).—Далее в кровяной плазме находятся нуклеопротеид и сером у к о -ид, содержащиеся в. небольшом количестве (0,1—0,25 г в 1 л) и очень мало изученные. Нуклеопротеид попадает при осаждении во фракцию глобулинов. Серомукоид принадлежит к гликопротеидам; не свертывается при кипячении, вследствие чего может быть принят за альбумозы. До сих пор является невыясненным, сколько групп и какие группы глобулинов и альбуминов находятся в сыворотке К. Имеются всевозможные постепенные переходы одной фракции в другую. Возможно, что дело заключается не столько в химич. различиях, сколько в различиях физ.-хим. состояния одного вещества. Следует отметить, что деление на фракции обнаруживается не только в вышеперечисленных свойствах, но касается и серологических, иммунных и ферментативных свойств глобулинов. Имеет значение не только общее количество белков плазмы, но и взаимное отношение фракций, к-рое при многих пат. процессах сильно изменяется. Отношение глобулинов к альбуминам, белковый коефициент, обозначают дробью, приравнивая количество глобулинов к 1; в норме оно колеблется от 1:1,5 до 1:2,3. Кроме того принято выражение «белковая картина крови» (Blut- eiweissbild), под к-рым понимают отношение обеих фракций, выраженное в процентах их общего количества; в норме это отношение =
33/
67; увеличение относительно-• го количества глобулина обозначается как сдвиг влево белковой картины крови. Наконец можно указывать просто количество глобулина в процентах общего количества белка, например 33%. Есть указания на то, что количество глобулинов увеличивается при различных процессах иммунизирования, но не пропорционально степени иммуниза-торного титра. При нек-рых патологических процессах, в особенности при болезнях, сопровождающихся лейкоцитозом, содержание глобулинов в К. может стать выше содержания альбуминов. При нефрите белковый коефициент может доходить до
1:11,3. — О происхождении белков крови известно пока мало. Повидимому в этом процессе играют известную роль кровообра-зующие органы (костный мозг). Многие наблюдения говорят о печени как о важном органе для образования фибриногена. Ряд авторов полагает, что в образовании белка К. участвуют не какие-либо определенные, но все органы, и что он представляет собой продукт разрушения белка последних. Вопрос о генетической связи глобулина и альбумина, важный для уяснения механизма изменений белкового коефициента и занимавший ряд авторов, еще не выяснен. Количественное определение белков может быть произведено свертыванием всех белков кипячением (желательное рН 5,5), взвешиванием промытого и высушенного осадка и определением в нем азота по Кьельдалю (см.
Къель-даля способ); помножив количество азота на коефициент 6,25, можно с большим приближением вычислить количество белка. Пользуясь способом Кьельдаля, можно определить и азот, приходящийся отдельно на долю фибриногена, глобулина и альбумина (распределение азота крови). Для этого определяют азот в плазме, сыворотке, фильтрате после осаждения глобулинов, в фильтрате после осаждения всех белков. В последнее время ряд авторов (Рона, Руш-няк) предложили нефелометрическое определение (см.
Нефелометрия). Очень удобен метод рефрактометрии. Для К. может итти речь о рефракции плазмы и сыворотки. Для исследования рефракции кровяной плазмы или сыворотки более всего пригодны рефрактометры Аббе или Пульфриха (Abbe, Pulfrich); первый дает непосредственно показатель, преломления, второй—т. н. Пульфриховские единицы__р е (1 Р. Е. соответствует приблизительно Zlw=0,00036—0,00038), по к-рым с помощью таблиц можно найти показатель преломления. Рефракция кровяной плазмы слагается из рефракции воды
(п для 17,5°— 1,33320), рефракции, приходящейся на долю неорганических и органических небелковых составных частей [в норме
А п (повышение показателя преломления по сравнению с показателем преломления воды)=
=0,00200—0,00277], и рефракции белков (в норме
An около
0,01800); для плазмы сюда присоединяется рефракция фибриногена
(An — 0,00080). Как видно, белки оказывают на рефракцию наибольшее влияние, причем более дисперсные альбумины имеют рефракцию ниже, чем менее дисперсные глобулины (рефракция альбуминов в 1 %-ном растворено,00177, рефракция глобулинов в 1 %-ном растворе=0,00229; Robertson). Рефракция сыворотки человека при нормальных условиях = 1,34873—1,35168. При нормальных условиях и в большинстве пат. состояний содержание в сыворотке воды и кристаллоидов колеблется в столь узких пределах, что колебания рефракции могут быть отнесены за счет увеличения или уменьшения количества белков (Reiss). Исключение составляют лишь уремия и гипергликемия, при которых количество небелковых веществ, преломляющих свет, в сыворотке сильно увеличено и должно быть принято во внимание при определении рефракции.— Для рефрактометрических исследований можно пользоваться капилярной, венозной или артериальной кровью, но существенно, чтобы при взятии крови не были сдавлены сосуды во избежание примешивания тканевой лимфы к исследуемой К.—При исследовании плазмы безусловно недопустимо применение противосвертывающих веществ, так как они изменяют рефракцию трудно учитываемым образом. Возможно лишь прибавление небольшого количества хорошего препарата гирудина или гепарина. Лучше всего производить определения в "так наз. натуральной нативной плазме, т. е. плазме, полученной быстрым центрифугированием во льду и в парафинированных пробирках цельной крови без предварительного прибавления противосвертывающих веществ.— При исследовании сыворотки следует всегда получать ее одинаковым образом, т. к. в зависимости от того, получена ли сыворотка центрифугированием цельной свернувшейся крови или дефибринированной или из натуральной плазмы, величины рефракции ее различны. Гемолиз, где бы то ни было, недопустим. Так как рефракция зависит почти от всех компонентов К., то едва ли величина ее имеет самостоятельный интерес как постоянная той или другой К.; скорее исследования рефракции интересны потому, что они дают возможность методически просто определять количественно белки в небольшом количестве К. и косвенно судить о содержании в ней воды. Для этой цели предложено 3 метода.
I. Метод Рейса (Reiss). Приняв
An небелковой части за постоянную величину— 0,00277, a
An белка сыворотки (смеси альбуминов и глобулинов) в 1 %-ном растворе за 0,00172, Рейс составил таблицу, с помощью к-рой, имея показания рефрактометра в Р. Е. при 17,5°, прямо находят процент белка. В дальнейшем цифры рефракции, положенные в основу таблицы Рейса, оказались неверны, и Робертсон предложил пользоваться постоянными: 0,00208 и 0,00195 (это последнее число соответствует белковой смеси, состоящей из
а/з альбумина и V« глобулина, как это обычно и бывает в сыворотке). Несмотря на эту поправку метод Рейса дает лишь приблизительные результаты, так как основные положения его неверны; в действительности: 1) рефракция небелковой части в разных случаях различна, 2)
An 1 %-ного раствора белка сыворотки также не представляется величиной постоянной и меняется в зависимости от соотношения в белке данной сыворотки фракций альбуминов и глобулинов.
Г. Дервиз. II. Метод Робертсон а. В противоположность Рейсу Робертсон указал на то, что рефракции белковых тел составляются аддитивно из рефракций отдельных видов белков (глобулинов, альбуминов). Метод Робертсона слагается из трех частей: из определения рефракции 1) безбелковой части сыворотки, 2) альбуминов и 3) глобулинов. 1) Рефракция безбелковой части сыворотки определяется кипячением с равным объемом
и/г5 уксусной кислоты и последующим рефрактометрическим измерением фильтрата. Из полученного числа вычитают рефракцию
п1во уксусной к-ты. Разность, умноженная на 2, дает рефракцию безбелковой части сыворотки. В виду того что безбелковая часть преимущественно состоит из NaCl, а другие вещества имеют сходный с NaCl показатель преломления, полученное число делят на 0,00160 (рефракция 1%-ного раствора NaCl). Т. о. получается процентное содержание безбелковой части, выраженное в виде NaCl. 2) Определение альбуминов. К сыворотке добавляют равный объем насыщенного раствора сернокислого аммония; осаждаются глобулины, остаются в растворе альбумины. Центрифугируют, отсасывают прозрачную жидкость, разводят равным объемом воды, взбалтывают и рефрак-.тометрируют. Из полученного вычитают рефракцию
lU насыщенного раствора (NFI
4)
2S0
4. Разность, умноженная на 4, дает рефракцию альбуминов и бёзбел-ковой части сыворотки. Вычитая из этой разности число, полученное при первом определении, и разделив полученное на 0,00177 (рефракция1 %-ного раствора альбуминов), получают процентное содержание альбуминов. 3) Определение г л о б у л и н о в. Определяют рефракцию неизмененной сыворотки, вычитают из нее рефракции дестилированной воды при той же t°, безбелковой части, альбуминов и получают т. о. рефракцию глобулинов. Разделив полученное число на 0,00229 (рефракция 1 %-ного раствора глобулинов), получают процентное содержание глобулинов. Бергер (Berger) основал на этом же принципе определение псевдоглобулина и эйглобулина. Метод Робертсона имеет несколько источников ошибок: 1) рефракция насыщенного раствора (NH
4)
2S0
4 подвержена колебаниям; 2) методы осаждения белков кипячением с уксусной к-той и высаливания глобулинов полунасыщением (NH
4)aS0
4 не могут считаться безупречными; 3) рефракции для1%-еых растворов альбумина и глобулина не могут считаться постоянными, т. к. в сыворотке содержатся различные виды альбуминов и глобулинов и в данной сыворотке могут преобладать те или другие виды. Поэтому нельзя дать постоянную величину рефракции для 1 %-цых растворов глобулина и альбумина.'
Ю. Гефтер, Г. Д'ервиз. III.
M стод.Ро.рера (Rohrer) основан на том, что растворы альбумина и глобулина сильно отличаются по вязкости. Рорером предложена в системе координат таблица, по которой, зная для данного раствора две физ. величины—рефракцию и вязкость его, можно найти процентное содержание в нем альбумина и глобулина. В таблице на ординате отложена рефракция в Р. Е., на абсциссе—вязкость сыворотки, определенная с помощью вискозиметра Гесса (Hess) (см.
Вискозиметрия). Результаты, полученные по методам Ро-рера и Робертсона, часто, особенно в патолог. случаях, не совпадают между собой, но для клинических целей они достаточно точны. Особенно быстро выполним метод Рейса [в случаях с изменяющимся количеством небелковых составных частей (напр. нефрит) этот метод недостаточно надежен]. — Фи-з и о л. цифры р е ф р а к ц
и и белков К. В норме рефракция сыворотки для данного индивидуума колеблется сравнительно в небольших границах (1—8 единиц в 4-м десятичном знаке).—Нормальные средние цифры рефракции натощак в спокойном состоянии следующие. I Новорожд. . ! 1.34575—4798 48—54
5,4—в,5 Дети . . . . 1,34687—4873 ! 51—65
5,9—6,9 Взрослые . .
\ 1.34836—5132 ■ 55—63
6,6—8,2 Для колебаний величины рефракции особенно важны следующие моменты: 1) обмен воды между сывороткой и форменными эле- ментами и между сывороткой и тканями; 2) увеличение или уменьшение небелковой части сыворотки; 3) образование или потребление белков. — Величина рефракции в течение дня изменяется крайне незначительно и случайно, что отражается лишь на десятых долях процента белка. Питье оказывает кратковременное влияние на величину рефракции, так как вода быстро элиминируется в ткани или почками. Сильное потение ведет к повышению рефракции; при бальнеологических тепловых процедурах бывает незначительное повышение рефракции (до 1 единицы в 3-м десятичном знаке). Принятие пищи не оказывает влияния на рефракцию, но при длительном недоедании количество белка падает. Умеренные работа и движение мало отражаются на рефракции; при более сильной работе наступают и более сильные изменения. При перегревании организма наступает резкий левый (см. выше) сдвиг белковой картины К.—При беременности наблюдается увеличение глобулиновой фракции. Изменения рефракции (т. е. концентрации белков) в пат. случаях могут зависеть от первичного изменения количества белка (hypoproteinaemia, hyperproteinaemia) или от первичного изменения количества жидкости в крови (hydraemia). При процессах иммунизации повышается содержание белков в плазме, причем возрастает фракция глобулинов.—При острых инфекционных заболевай и я х (инфлюен-ца, пневмония, скарлатина, нагноения) сначала наступает нек-рое уменьшение белка, затем увеличение, могущее держаться довольно долго; увеличение захватывает фракции белка в следующем порядке: фибриноген, глобулины и альбумины.—При х р о н. б - н я х (напр. tbc) наступает увеличение содержания белка, касающееся гл. обр. глобулинов. Белковый коефициент уменьшается, белковая картина К. претерпевает левый сдвиг. При tbc увеличение фракции глобулинов идет пропорционально тяжести заболевания, что дает возможность использовать рефракцию как прогностический признак. — При новообразованиях чаще наблюдается уменьшение содержания белка, но бывает и увеличение, что зависит от места локализации опухоли; при лечении светом содержание белка б. ч. повышается, т. к. продукты распада стимулируют увеличение фракции глобулинов. Изменения рефракции и количества белка, наступающие вследствие первичного изменения в количестве жидкости, наблюдаются гл. обр. при заболеваниях почек, жел .-кишечного канала, нарушениях циркуляции, обмена веществ.—Н едостаточность почек ведет к уменьшению рефракции, к-рое может быть обнаружено в сыворотке раньше, чем наступают отеки (рефракция доходит до 1,3518—1,3543). При стенозах пищевода и привратника, когда затруднен прием пищи, рефракция поднимается иногда до 4 единиц во 2-м десятичном знаке. При поносах рефракция изменяется различно. При компенсированных болезнях сердца рефракция не изменяется; при наступающей де- компенсации и увеличении в крови С0
2— падает вследствие поступления воды из форменных элементов и тканей в плазму. При диабете, ацидозах также наступает уменьшение рефракции (закисление, как например при впрыскивании кислых буферных растворов, ведет к значительной гидремии).
г. Дервиз. Углеводы К. В К. находятся глюкоза, ^-фруктоза и очень небольшие количества гликогена (2—5
мг %); содержание в К. мальтозы, изомальтозы и пентозы не доказано с положительностью; при введении per os сахарозы и лактозы эти углеводы могут временно
* появиться в крови. Некоторые авторы высказывали предположение, что глюкоза нормальной К. не есть обычная равновесная смесь 2 стереоизомерныхформ:
а- и ^-глюкозы, а представляет собой нестойкую, легко подвергающуюся расщеплению у-глюкозу, появляющуюся под влиянием совместного действия печени и поджелудочной железы; при сахарной болезни в крови по мнению этих авторов нет у-фор-мы, которая только одна и может разрушаться клетками, в отличие от а-и /3-форм. Это предположение недостаточно обосновано, [равно как и мнение некоторых авторов, что значительная часть сахара находится в плазме в связанном (с белками) виде; если такой сахар и имеется в К., то лишь в очень небольшом количестве по сравнению с свободной глюкозой. Что сахар крови есть глюкоза, доказал в 1846 г. Ма-жанди (Magendie). Михаелис, Рона и др. показали, что вопреки прежнему мнению эритроциты также содержат в себе сахар, количество к-рого значительно колеблется у различных видов животных. У отдельных видов животных количество глюкозы в плазме лежит в пределах от 0,05% до 0,2%; у здоровых людей в К. — от 0,08% до 0,116%; в плазме: 0,098— 0,114%. Артериальная К. содержит глюкозы на 0,01—0,02% больше, чем венозная. После сбраживания сахара К. дрожжами остается восстанавливающая способность К., к-рая носит название остаточной редукции и может быть обусловлена содержанием в крови глюкуроновых кислот и др. как безазотистых, так и азот-содержа-щих веществ. Величина остаточной редукции в нормальных условиях незначительна (0,005%). Количество сахара в К. животных и людей может изменяться при различных условиях. Определение количества сахара в крови наряду с исследованием мочи имеет большое значение для клиники в виду того, что определением сахара в К. удается при отсутствии гликозурии обнаружить лятентные случаи нарушения углеводного обмена. Определенного соотношения между количеством сахара в К. и в моче не существует; пропускная способность почек для сахара колеблется. По сравнению с однократным определением сахара в К., к-рое производится натощак, лучшее представление о степени нарушения углеводного обмена дает выведение сахарных кривых, т. е. определение сахара в К. через известные промежутки времени после нагрузки глюкозой. Повышение содержа- ния сахара в К., гипергликемия, наступает при кормлении большими дозами; это явление—преходящего характера и носит название пищевой или алиментарной гипергликемии; обычно уже в течение нескольких часов количество сахара крови доходит до нормы. Временная гипергликемия развивается после
Бернара сахарного укола (см.) и может наступать под влиянием сильных эмоций, наркоза, кровопускания, введения кофеина, диуретина, адреналина и др., при отравлении окисью углерода, мышьяком, ртутью, морфином, амилнитри-том и др. Гипергликемия встречается при лихорадочном состоянии, при органических заболеваниях мозга, при сотрясении его, при псих, заболеваниях, при кожных болезнях. Наиболее сильная и постоянная гипергликемия (до 0,4%, редко выше) и наибольшие уклонения сахарных кривых от нормы наблюдаются при
диабете сахарном (см.). Помимо поражений поджелудочной железы, вызывающих диабет, нарушение функций других эндокринных желез также может вести к гипергликемии, к-рая наблюдается например при б-ни Базедова, поражениях гипофиза, особенно при заболеваниях с акромегалическими симптомами; повторные инъекции экстракта гипофиза, электрическое раздражение гипофиза вызывают гипергликемию. При нефритах часто наблюдается повышенное содержание сахара в крови, причем нередко гликозурия при этом отсутствует, что объясняется тем, что при поражении почек пропускная способность их для сахара уменьшается.—Гипогликемия встречается значительно реже, чем гипергликемия. Гипогликемия наблюдается при продолжительном голодании, при водянке, при Аддисоновой б-ни, после удаления печени, при микседеме, кретинизме. Для клиники наибольшее значение имеет гипогликемия, развивающаяся в результате инъекций
инсулина (см.).— При мышечной работе количество сахара в К. повышается, но если эта работа ведет к истощению, то наоборот может наступить гипогликемия вследствие усиленного использования запасов гликогена, напр. после Марафонского бега (см.
Обмен веществ, углеводный). Ю. Гефтер, С. Северин.
Для определения количества сахара в К. предложено несколько методов; из них в наст, время наиболее распространенным в клинич. и лабораторной практике является метод Хагедорна-Иенсена (Hage-dorn, Jensen), принцип к-рого заключается в следующем: к освобожденному от белков К. фильтрату прибавляется титрованный раствор железосинеродисто-го калия K8Fe(CN)e; образовавшийся после окисления глюкозы железистосинеродистый калий K4Fe(CN)e выпадает в присутствии сернокислого цинка в осадок; избыток K8Fe(CN)e, не вступивший в реакцию с глюкозой, определяется иодометрически согласно следующему уравнению: 2KaFe(CN),+2HJ = = 2K4Fe(CN)e+ «Г2. Для определения сахара достаточно 0,1 см3 крови. Необходимые реактивы (не содержащие примеси солей железа): 1) 0,45%-ный раствор сернокислого цинка; 2) и/10 раствор NaOH; 3) 1,65 г K,Fe(CN)e+10,6 г безводного Na2COa растворяют в 1 л дестил. воды; 4) 50,0 г ZnSO4+250,0 г NaCl в 1 л дестил. воды; при употреблении этого реактива к нему добавляют KJ в количестве 2,5%; 5) 3%-ная уксусная к-та (не содержащая железа); 6) растворимый крахмал; 7)
и/
20о раствор гипосульфита (Na
2S
20
8).—X од определения: для осаждения белков К. в пробирку вводят 1
см3 п1ю раствора NaOH (2) и 5
см3 0,45%-ного раствора ZnS0
4(l). Выпадает белый хлопьевидный осадок гидроокиси цинка. После введения 0,1
см3 крови пи- ■685 Таблица для определения сахара в К. по X а ге д о р ну-Иенсену. j Na
aS
2O
s см3 0,00 0,01 0,02 0,03 0,04 ! 0,05 0,08 0,07 0,08 0,09 [
1 0,0 0,385 0,382 0,379 0,376 0,373 0,370 0,367 0,364 0,361 0,358 I 0,1 0,355 0,352 0,350 0,348 0,345 0,343 0,341 0,338 0,330 0,333 0,2 0,331 0,329 0,327 0,325 0,323 0,321 0,318 0,di6 0,314 0,312 i 0,3 0,310 0,308 0,306 0,304 0,302 0,300 0,298 0,296 U .294 0,292 | 0,4 0,290 0,288 0,286 0,284 0,282 0,280 0,278 0,276 0,274 0,272 0,5 0,270 0,268 0,266 0,264 0,262 0,260 0,259 0,257 0,255 0,253
' 0,6 0,249 0,247 0,245 0,243 0,241 0,240 0,238 0,236 0,234 0,7 0,232 0,230 0,228 0,226 0,224 0,222 0,221 0,219 0,217 0,215 0,8 0,213 0,211 0,209 0,208 0,206 0,204 0,202 0,200 0,199 0,197 0,9 0,195 0,193 0,191 0,190 0,188 0,186 0,184 0,182 0,181 0,179 , 1,0 0,177 0,175 0,173 0,172 0,170 0,168 0,166 0,164 0,163 0,161 1Д 0,159 0,157 0,155 0,154 0,152 0,150 0,148 0,146 0,145 0,143 1 1,2 0,141 0,139 0,138 0,136 0,134 0,132 0,131 0,129 0,127 0,125 ! 1,3 0,124 0,122 0,120 0,119 0,117 0,115 0,11,3 0,111 0,110 0,108 i i.
4 0,108 0,104 0,102 0,101 0,099 0,097 0,095 0,093 0,092 0,090 !
1,5 0,088 0,086 0,084 0,081 0,079 0,077 0,075 0,074 0,072 1 1,6 0,070 0,068 0,066 0,065 0,063 0,031 0,059 0,057 0,056 0,054 i *'
7 0,052 0,050 0,048 0,047 0,045 0,043 | 0,041 0,039 0,038 0,036 ! 1,8 0,034 0,032 0,031 0,029 0,027 0,025 0,024 0,022 0,020 0,019 ! 1,9 0,017 0,015 0,014 0,012 0,010 0,008 0,007 0,005 0,003 0,002 летку 2 раза ополаскивают находящейся в пробирке смесью и оставляют в течение трех минут в кипящей водяной бане. Белок свертывается. К освобожденному от белков количественно собранному фильтрату прибавляют 2
см3 раствора № 3 и нагревают в кипящей водяной бане в течение 15 минут. По охлаждении добавляют 3
см3 раствора № 4, затем 2 си
3 уксусном к-ты(№ 5) и несколько капель раствора крахмала (№ 6). Оттитровывают выделившийся свободный иод "Угоо раствором гипосульфита (№ 7). Титр гипосульфита проверяется по точному
и/
2оо раст-вару кислого иодноватокислого калия (KJ0
3+HJ0
3). Параллельно необходимо ставить контрольный (слепо ir) опыт, т. е. вести определение, как указано, не добавляя крови. Вычисление производится по прилагаемой таблице. Пользуются таблицей таким образом, что в левом столбце (крайнем) находят число целых и десятых долей
смг п/
200 раствора Na
2S
20
3, истраченного при титровании, а в верхнем горизонтальном ряду-—-число сотых долей. Найденная на месте перекреста линий, проведенных от этих чисел, величина в таблице указывает количество
мг са-хара в 100
см3 взятой для анализа крови. Пример. При титровании содержимого контрольной пробирки пошло 1,98
см* п/2М раствора Na
2S
a0
3, что соответствует 0,003
мг глюкозы. При титровании содержимого пробирки с кровью пошло 1,43
см3, что соответствует 0,101
мг глюкозы. Количество сахара в 0,1 см
8 К.=0,101—0,003=0,098
мг, или 98
мг %. Липоиды исследуются в эфирном или алкогольно-эфирном экстракте К. В норме в сыворотке К. человека натощак отдельные составные части эфирного экстракта распределяются след. образом: общее количество жирных к-т—0,25—0,47%, в среднем— 0,38%; нейтрального жира—0,04—0,2%, в среднем — 0,11%; лецитина (фосфатиды)— 0,17—0,26%, в среднем—0,2%; холестерина—0,18—0,31%, в среднем—-0,2%. Отношение -
ле5
и^
11.— являющееся доволь-
холестерин' ^ но постоянным, равно 0,82—0,96. Общее количество эфирного экстракта плазмы— 0,72 г на 100
см3. Содержание в крови указанных веществ мало зависит от возраста, пола, но чрезвычайно колеблется в связи с родом питания. При введении в организм жиров все части эфирного экстракта резко увеличиваются (алиментарная л и п е м и я), что часто удается установить уже по внешнему виду сыворотки
■, заметно в этих случаях опалесцирующей. При голодании количество липоидов в К. сначала увеличивается, затем при развивающемся истощении падает ниже нормы. При пищевых режимах, бедных жиром, содержание в крови веществ, экстрагируемых эфиром, держится на низком уровне (см. также
Липемия).—Холестерин К.—см.
Ги-перхолестеринемия. Лецитин в К. в нек-рых отношениях антагонистичен холестерину (напр. вызывает гемолиз, увеличивает стабильность су-спенсии эритроцитов и т. д.). Методы определения липоидов в К. были предложены Бангом и модифицировались затем многочисленными исследователями, но и до наст. времени они не могут быть признаны технически простыми и достаточно точными. При определении липоидов К. особенное значение имеет чистота посуды и реактивов. Определение жирных к-т и холестерина, по Бангу, в модификации Блура (Bloor) основано на окислении жирных к-т и холестерина раствором хромовой к-ты, избыток к-рой определяется иодометри-ческим титрованием. Восстанавливающая способность пальмитиновой к-ты—3,51; олеиновой к-ты—3,61; стеариновой—3,66; холестерина—3,92; лецитина—3,11; кефалина—3,12. Числа обозначают количество
см3 п[10 раствора бихромата, к-роевосстанавливается одним
мг вещества. Реактивы: 1)
и/
10 раствор Na
2S
sO
a; 2) п раствор двухромовокислого калия К
2Сг
8О
7(4,904
г до 1.000
см3 воды); 3) раствор крахмала; 4) 10%-ный раствор KJ; 5) раствор двухромовокислого серебра в серной к-те: к 25
см3 25%-ного раствора AgNO, в Распределение холестерина в крови, по ХюкуиУокеру (Hueck, Wacker). Вид животного Кролик Лошадь Собака . Цельная кровь Свободный) Эстеры холестерин холестери- i на Общее количество холестерина Сыворотка Свободный | эстеры холестерин холестерина Отношение свободного холестерина к эстеру |холестерина Общее количество 0,07 0,0618 0,0997 0,0228 0,0360 0,0469 0,0928 0,0978 0 ,1466 0,02 0,018 0,0365 6.8 8 большой центрифужной пробирке прибавляют 50
см3 10%-ного раствора К
2Сг
гО,; осадок Ag
2Cr
20
7 центрифугированием и последующим отсасыванием собирающейся над осадком жидкости промывают несколько раз водой и затем растворяют в 500
см3 концентриро-ваннойН
280
4;6)петролейный эфир(t°кипения60—70°); 7) эфирно-алкогольная смесь: 3 части 95%-ного алкоголя смешивают с 1 ч. эфира (оба реактива 2 раза перегнаны); 8) этилат натрия, приблизительно п раствор: 2—3
г металлического Na растворяют (охлаждая льдом) в 100
см3 абсолютного спирта (раствор сохраняют в темноте).— Ход определения. Экстракция: кЗ
см3 плазмы, помещенной в мерительную колбу емкостью в 50
см3, прибавляют постепенно, при постоянном помешивании, 40
см3 эфирно-алкогольной смеси (7), погружают в кипящую водяную баню до начала кипения, затем охлаждают и, долив до метки эфирно-алкогольной смесью, фильтруют через обезжиренный фильтр. — О пределе-ние общего количества липоидов. В Эрленмейеровской колбе емкостью в 100
см3 к 15— 20
см3 полученного фильтрата прибавляют 2
см3 раствора этилата натрия (8) и нагревают на водяной бане до исчезновения запаха алкоголя. От остатков алкоголя освобождаются просасыванием воздуха. К вязкому содержимому добавляют 1
см3 H
2S0
4(1:3), • нагревают на водяной бане 1 мин-, и экстрагируют полученный раствор в течение 2—3 мин. при помощи 10
см3 кипящего петролейного эфира. Слив петролей-ный эфир в мерительную колбу емкостью в 25
см3. экстракцию повторяют 3—4 раза порциями по 5
см3, к-рые сливают в ту же мерит, колбу. По охлаждении жидкость доводят до метки петролейным эфиром и закрывают пробкой экстракт № 1 (Э. 1). — Окисление. 10
см3 экстракта (Э. 1) выпаривают в Эрленмейеровской колбе, снабженной притертой пробкой, до исчезновения запаха петролейного эфира, от остатков к-рого освобождаются продуванием через колбу воздуха. К остатку прибавляют в качестве катализатора 5
см3 раствора хромовокислого серебра в серной к-те (5), 3
см3 п раствора двухромовокислого калия (2) и ставят на 5 мин. в сушильный шкаф при t° в 124°.—Ставят при тех же условиях слепой опыт с одними реактивами в качестве контроля. Вынув колбы, перемешивают покачиванием их содержимое, плотно прикрывают притертыми пробками и вновь ставят в шкаф на 10—15 мин. Вынув колбы, в них, не охлаждая, наливают по 75
см3 воды, 10
см3 10%-ного раствора KJ и быстро титруют
и/
10 раствором гипосульфита, избегая перебалтывания в начале титрования во избежание потери иода. Под конец энергично перебалтывают, прибавляют раствора крахмала и титруют до исчезновения синей окраски. Разность в количестве
см3 njw раствора гипосульфита, истраченных на титрование после обработки одних реактивов (слепой опыт) и анализируемой смеси, указывает количество
см3 к/ю раствора бихромата, пошедших на окисление жирных к-т и холестерина.— Пример. При титровании в слепом опыте пошло 33,0
см3, с исследуемой пробой — 23,45
см3 и/
10 раствора гипосульфита, что соответствует 9,55
см3 9 55
п1ю раствора бихромата или
' =2,65
мг олеиновой кислоты. — Для определения холестерина другие 10
см3 экстракта (Э. 1) выпаривают, как это описано выше. Для растворения остатка малыми порциями добавляют хлороформ, слегка подогревают и декантируют в мерительном цилиндре на 10
см3. Повторив экстракцию 3 раза, доливают хлороформом до 5
см3, прибавляют 1
см3 уксусного ангидрида и 0,1
см3 концентрированной H
2S0
4. Одновременно таким я^е путем обрабатывают стандартный раствор, содержащий в 5
см3 хлороформа 0,5
мг холестерина. Растворы перемешивают, оставляют в темном месте на 15 м. и затем колориметрируют.— Р а с ч е т: полученное количество
мг холестерина, умноженное на 3,92, вычитается из количества
см3 бихромата, пошедшего на окисление общего количества жира и холестерина; разность делится на 3,60 (3,92—число
см3 м/ю раствора хромовой к-ты, окисляющее 1
мг холестерина; 3,60—среднее из 3,59 и 3,61, т. е. чисел, характеризующих восстановительную способность пальмитиновой и олеиновой кислот). Определение фосфатидов (лецитина и кефалина, по Блуру). Принцип: липоиды, изолированные осаждением алкогольного экстракта крови ацетоном и хлористым магнием, окисляют хромовой к-той. 1
мг лецитина окисляется 3,11
см3 и/
10 раствора хромовой к-ты, 1
мг кефалина—3,12
см3; другие липоиды обладают мало отличающейся восстановительной способностью, что дает право Блуру принять для всех липоидов фактор, равный 3
см3 и/ю раствора бихромата для 1
мг фосфалипоида.'—В мерительную колбу емкостью в 100
см3, содержащую 75
см3 перегнанного 95%-ного алкоголя, приливают при постоянном помешивании 5
см3 К.; нагревают на водяной бане до кипения, кипятят 5 мин; охладив, доливают алкоголем до метки и фильтруют через обезжиренный фильтр; 20
см3 фильтрата выпаривают досуха, остаток экстрагируют кипячением с небольшими порциями петролейного эфира, сливаемого в градуированную центрифужную пробирку емкостью в 15
см3. Когда объем экстракта станет равным 10
см3, его центрифугируют, прозрачный центрифугат переливают в другую градуированную центрифужную пробирку, погружают ее в теплую воду и осторожно выпаривают петролейный эфир, доводя объем экстракта до 2
см3. Приливают 7
см3 перегнанного ацетона, 3 капли насыщенного на холоде алкогольного раствора MgCl
2; размешивают, центрифугируют, сливают прозрачную жидкость и, промыв осадок ацетоном, растворяют его в 5
см3 влажного эфира, свободного от перекисей. Прозрачный эфирный экстракт, количественно собранный в колбу для окисления, выпаривают, причем от остатков эфира освобождаются просасыванием воздуха. Прибавив в колбу 5
см3 раствора серебра (5) и 3
см3 п раствора двухромовокислого калия (2), проводят окисление и последующее титрование, как описано выше (определение жира и холестерина). Количество фосфатидов во взятой для анализа пор-
а—Ъ ции экстракта равно —^—
мг, где
а—число
см3 w/
10 раствора гипосульфита, пошедшее при титровании исследуемой пробы,
Ь—число
см3 и/
10 раствора гипосульфита, пошедшее при титровании в слепом опыте, 3—число
см3 ni10 раствора бихромата, идущее на окисление 1
мг фосфатидов.—Для определения фосфора липоидов, по Блуру, к остатку после выпаривания алкогольно-эфирного экстракта крови, взятого в количестве 5
см3, прибавляют 0,5
см3 смеси из концентрированных серной и азотной к-т (1:1) и нагревают до получения бесцветного прозрачного раствора. Разбавив водой* нейтрализовав щелочью и доведя водой до 5
см3, в полученной жидкости колориметрически определяют фосфор (см. ниже фосфор крови). Лецитин содержит около 4 % фосфора. — Определение холестерина, по С. Гьерги (Szent-Gyorgyi). Метод основан на осаждении свободного-холестерина дигитонином и на взвешивании полученного осадка. В экстракте К. (соответственно 1
см3) холестерин осаждают прибавлением 1
см3 раствора дигитонина (1
г кристаллического дигитонина в 50
см3 80%-ного алкоголя). Полученную смесь выпаривают на водяной бане до половины объема, дают постоять при комнатной t° и через V
4 часа фильтруют под давлением через асбестовый фильтр. При помощи 7
см* 80%-ного ацетона осадок смывают в центрифужную пробирку, погружают ее в водяную баню (t° в 45—50°), помешивают содержимое стеклянной палочкой и через 5 мин. центрифугируют. Отсосав жидкость через асбестовый фильтр [рис. 14 (ст. 675—676)], осадок промывают сначала 80%-ным, затем чистым ацетоном. Разболтав осадок в воде (t° в 50°), его полностью переносят на тот же фильтр, воду отсасывают, осадок на фильтре высушивают и взвешивают. Для вычисления количества холестерина найденный вес осадка умножают на 0,2431 (Windaus).
Минеральные вещества К. Гейбнер (Heub-ner) приводит следующую таблицу содержания минеральных веществ в нормальной. плазме К. человека. Мин. вещества С1 . НСОз
so4. НР0
4 Колебания (в
мг%) I Концентрация в средние эквивален. предель ные 320—400 3—-15 355 160 22 10 Na........!
280—320 К.........|
16—24 Са........
! 8—16 Mg........
1—4 Сумма...
— 300 20 10 2,5 879,5 0,100 0,026 0,005 0,002 0,130 0,005 0,005 0,002 0,133 К-Т 0,142 оснований У различных видов животных, а также в различных частях К. (плазма, сыворотка pi кровяные тельца) содержание минеральных веществ неодинаково. Эти различия могут быть значительными, как это видно из анализов Абдергальдена. 1.000 вссо-вых частей цельной К. содержат: Элементы Лошадь Свинья ! Кролик Корова Вол Овца Коза Na . . . . ! 2,691 2,406 2,78 3,635 3,712 3,638 3,579 2,738 2,309 2,108 0,407 0,407 0,405 0,396 Са . . . . ; 0,051 0,068 0,072 0,069 0,064 0,07 0,066 Mg . . . . | 0,064 0,088 0,057 0,035 0,036 0,033 0,04 С].....! 2,785 2,69 2,898 3,079 3,081 3,08 2,92 Неорг. Р .
' 0,806 0,749 0,685 0,171 0,174 0,19 0Д42 Вода . . . 749,02 790,56 816,92 808,9 814,8 821,67 803,89 1.000 весовых частей сыворотки содержат: Элементы I Лошадь ; Свинья Na К Са Mg С1 Неорган. Вода . . 4,34 0,263 0,111 0,045 3,726 0,071 902,05- 4,251 0,27 0,122 0,041 3,627 0,052 917,6 Кролик 4,442 0,259 0,116 0,046 3,883 0,064 925,6 Корова 4,312 6,255 0,119 0,044 3,69 0,084 913,64 Вол 4,316 0,262 0,111 0,042 3,688 0,062 913,38 Овца 4,303 0,256 0,117 0,041 3,711 0,073 917,4 Коза 4,326 0,246 0,121 0,041 3,691 0,07 907,69 Коза : Собака Кошка 3,675 ! 3,686 0,25 0,26 0,062 ! 0.053 0,052 1 0,059 2,93 1 2,815 0,57 ! 0,55 810,0 795,5 Собака 4,63 0,226 0,113 0,04 4,02 0,08 923,98 Кошка 4,43 0,262 0,04 4,17 0,07 926,93 1.000 весовых частей кровяных телец содержат: Элементы . Лошадь Свинья
\ Кролик , Корова Вол Овца Коза Собака Кошка Na . . . К . . . Са . . . Mg . . . С1 . . . Неорган. Р. . . Вода . . 0,08 1.94 1,45 613,15 0,15 1,47 1,65 625,61 0,077 1,236 1,73 633,53 2,23 0,72 0,017 1,81 0,35 591,85 Минеральные вещества крови б. частью находятся в состоянии истинного раствора, частью же дают соединения с коллоидами. Возможна также адсорпция коллоидами как отдельных ионов, так и молекул солей. При вычислении суммы к-т и оснований в К. обнаруживается преобладание последних (см. выше). Степень ионизации отдельных солей зависит от соотношения ионов, находящихся в К.■— Значение электролитов в К. обусловлено следующими основными их функциями: 1) поддержанием на постоянном уровне осмотической концентрации К.; 2) сохранением на постоянном уровне активной реакции К.; 3) воздействием на обмен веществ в клетках; 4) влиянием на состояние коллоидов (см.
Ионы, физиол. действие).—Для жизни организма имеет значение не только присутствие тех или других минеральных веществ в К., но и определенное количественное соотношение их ионов. Так напр. по данным Гольвицер-Мейер (Gollwitzer-Meier) для возбудимости дыхательного центра имеет значение соотношение в К. ионов
[К-].[НР04 + Н2РО|]-[Са-'].[М£"Г
В наст, время предложено много методов для определения содержания электролитов как в цельной К., так и в плазме и сыворотке. При применении метода надо учитывать, что 1) при анализах золы определяются все соединения исследуемого компонента, как связанные с органическими 2,50 0,69 0,02 1,87 0,39 618,6 2,13 0.74 0,016 1,65 0,45 604,7 2,17 0,67 0,04 1,48 0,27 608,7 2.82 0^28 0,07 1,35 1,29 644,2 2,70 0,25 0,08 1,04 1,186 624,1 веществами, так и находящиеся в К. в виде минеральных соединений; 2) при анализах сыворотки часть Са, Mg и НР0
4 может выпадать с фибрином при свертывании; и 3) при изучении распределения минеральных веществ между плазмой и форменными элементами следует обращать внимание на то, чтобы активная реакция крови и содержание в ней СО
2 не менялись во время взятия крови и сохранения ее до анализа; иначе может наступить изменение распределения ионов между плазмой и кровяными тельцами. Определение общего количества оснований в сыворотке К. обычно производят методом электродиализа (см.
Диализ). Определение способной к диализу части К, Na, Ca, C1 и т. д. методом компенсационного диализа (Рона). В пробе сыворотки определяют общее количество. того вещества, способную к диализу часть к-рого хотят установить. В ряде других проб возможно большее количество сыворотки диализируется против возможно малого количества раствора соли исследуемого электролита, причем этот наружный раствор делается изотоничным сыворотке прибавлением других, не входящих в исследование соединений. Концентрация соли исследуемого вещества варьирует в различных параллельных опытах, т. ч. она то выше то ниже, чем в сыворотке. Через определенное время, напр. через 24 часа, наступает равновесие между наружной и внутренней жидкостью; диализ копчается, и определяется концентрация исследуемого вещества в отдельных пробах наружной жидкости. В одной из ряда проб концентрация не меняется; следовательно-она равна концентрации способной к диализу части исследуемого вещества в анализируемой сыворотке. Кальций находится в плазме частью в виде свободных ионов, частью в виде недиссоциированной соли Са(НС0
3)
2 к частью в соединении с коллоидами. Методом компенсационного диализа Рона и Та-кагаши (Takahashi) установили, что количество свободных ионов кальция составляет ■3
мг%, кальций органических соединений составляет 25—30% остального количества кальция и до 65—
1Ь% приходится на долю недиссоциированной соли. Различные белки крови обладают различной способностью (при одинаковом рН) связывать кальций; 100
г фибрина могут связать 11,5
мг кальция, глобулина—37,0 и альбумина—78,0. Всего белки плазмы могут связать
1/
3 часть общего количества кальция.—Физиологически действующей частью кальция считается его ионизированная форма. Для ионов кальция так же, как и для водородных, в организме существует буферная система. По Рона и др., уменьшение концентрации ионов водорода и повышение концентрации ионов бикарбоната (НС0
3') и фосфата (НРО/) ведет к уменьшению концентрации ионов кальция (Са
--); обратные изменения вызывают ее увеличение. —-Содержание кальция в крови человека равно 10—12
мг%. В кровяных тельцах содержание кальция ничтожно (у собаки 2,5—3,0
мг % CaO) (Heubner). Соответственно с этим в цельной К. кальция меньше, чем в плазме и сыворотке. У челов жа содержание Са в цельной крови колеблется от 5,3 до 8,9
мг%, в сыворотке— от 9 до 13
мг%. Количество кальция в крови претерпевает в тзчение года колебания, причем самые низкие величины наблюдались в январе и сентябре, а самые высокие—в мае и ноябре. Вонозная кровь как правило содержит несколько больше Са, чем артериальная. При нормальных условиях содержание Са в К. довольно постоянно, и различные воздействия на кальциевый обмен здорового организма мало и лишь на небольшой срок изменяют содержание Са в К. Введение Са per os в небольших дозах не отражается на концентрации Са в К.; большие дозы (до 20
г) дают значительное повышение. Кровопускание до
х/б общего количества крови может вызвать в течение первого часа повышение Са в К., а в течение второго и третьего часа лишь незначительные колебания по сравнению с исходной концентрацией.
С. Северин. О специфическом действии иона Са—см.
Кальций. Тетанию и спазмофилию давно ставят в связь с нарушениями кальциевого обмена, причем гипокальце-мия наблюдается как при детской тетании (3,5—7
мг%), так и при тетании взрослых, даже и в скрытом периоде тетании. Пови-димому имеется зависимость между недостатком кальция вК. и повышением возбудимости нервно-мышечной системы, наблюдаемым при тетании. Точно также удаление паращито-видных желез у животных ведет к развитию тетании и уменьшению количества кальция в крови (McCallum, Voegtlin). В противоположность рахиту (см. ниже) при тетании имеются нормальные числа содержания фосфора в К. Несмотря на то что при рахите имеется сильное обеднение костей кальцием, в сыворотке находятся почти нормаль- ные количества Са или же числа, лежащие на низшей границе нормы. При сравнительно нормальных количествах кальция количество неорганического фосфора при рахите понижено (Howland, Kramer); авторы придают большое значение соотношению между Са и Р0
4. Содержание кальция в К. при tbc было предметом изучения многих авторов; большинство считает, что количество кальция в К. держится в пределах нормы, между тем как Бергейм (Bergeim) утверждает, что при tbc существует деминерализация, выражающаяся и в уменьшении кальция в крови.— При нефрите количество кальция может значительно понижаться, особенно в случаях нефрита, сопровождающихся признаками уремии, между тем как при гипертонии без ренальных симптомов количество кальция б. частью находили нормальным. При эклямпсии количество кальция в крови большей частью понижено; некоторые авторы смотрят на гипокальцемию как на этиологический момент, обусловливающий возникновение эклямпсии. При больших переломах костей наблюдается небольшое повышение кальция в крови при одновременном более значительном повышении неорганического фосфора (см. также
Обмен веществ, минеральный). Методы определения. Определение по де В а а р д у (de Waard). В случае исследования цельной К. предварительно осаждают белки или озоляют К.; сыворотку можно не сжигать. Из растворов золы после сжигания или из фильтрата после осаждения белков или из сыворотки кальций осаждается насыщенным раствором щавелевокислого аммония (C
20i+Ca" = CaC
20
4)- Промытый водой осадок щавелевокальциевой соли растворяют в крепкой ГШ0
3 и освободившуюся при этом щавелевую к-ту оттитровывают раствором марганцовокислого калин: 5Н
2С
20
4 + 2KMn0
4 + 6HN0
3 = 2KN0
3 + 2Mn(NO,)
2 + + 8Н
аО+10CO„.— Определение в сыворотке. 0,5 или 1
см3 вводят в центрифужную пробирку и прибавляют 0,5
см3 насыщенного раствора щавелевокислого аммония. Оставляют стоять 30 минут, после чего центрифугируют. Жидкость осторожно декантируют возможно полнее. Лучше всего это сделать при помощи приспособления, изображенного на рис. 15 (ст. 675—676). В короткую трубку вдувается воздух, жидкость поднимается по др. трубке, к-рая служит сифоном. Нижний конец длинной с очень узким просветом трубки изогнут крючком, чтобы осадок не всасывался в трубку. После этого прибавляют 2—3
см3 воды, взбалтывают осадок и снова центрифугируют. Повторив промывание 2—3 раза, к осадку прибавляют 0,3
см3 крепкой HN0
3, подогревают на водяной бане до 50—70° и по растворении осадка титруют из микробюретки
ni60 КМпОч до появления держащейся в течение 2 мин. слаборозовой окраски. Определение в цельной крови. 0,5—1,5 си
3 крови помещают в платиновый тигель и сначала высушивают на слабом, потом сжигают на сильном огне до полного озоления, золу растворяют в нескольких каплях разведенной соляной кислоты (не больше 1
см3), раствор количественно (многократно споласкивая тигель малыми порциями воды) переводят в центрифужную пробирку. К полученному раствору СаС1
2 прибавляют 0,5
см3 насыщенного раствора (NH
4)
aC
20
4, ставят в кипящую водяную баню, прибавляют несколько капель концентрированного NH
a и осторожно подкисляют ледяной уксусной к-той. Смесь охлаждают и через 15—30 мин. центрифугируют. Жидкость осторожно декантируют и в дальнейшем ведут определение, как описано для анализа Са в сыворотке. При определении кальция дестили-рованная вода должна быть дважды перегнана. Определение следует производить в пробирках из иенското стекла.—Р а с ч е т. Из израсходованного на титрование количества
см.3 и/
60 КМп0
4 вычитают 0,01
см3 или 0,02
см3—количество, к-рое необходимо, чтобы в слепом опыте получить заметно розовую окраскур-1
см3 п1ы раствора КМп0
4 соответствует 0,4
мг Са. Полученный результат, относящийся ко взятому количеству К. или сыворотки, следует привести к 100
см3.—Определение по методу Крамер-Тисдаля— см.
Кальций. *
«93 Калий. Бблыпая часть калия, целиком i проходящего через ультрафильтр, находится в крови в диссоциированном состоянии. Рона и Петов (Petow) показали, что калий не входит в соединение с коллоидами сыворотки. Содержание калия в сыворотке человека у отдельных индивидуумов довольно постоянно и составляет 16—24
мг%, в цельной К.—150—200
мг%.—По Цондеку (Zondek), содержание калия в К. связано с деятельностью вегетативной нервной системы. Так, у ваготоников находили более низкие числа для К., чем у симиатикото-ников. Однако многочисленные литературные данные по этому вопросу далеко не 'Однообразны. Увеличение калия в К- наблюдается при почечной недостаточности, при эссеЕщиальной гипертонии, астме, заболеваниях циркуляторного аппарата с явно выраженной недостаточностью. Быз-.лов отмечает резкое увеличение калия в К. скарлатинозных б-ных. Содержание калия в К. в значительной степени зависит от количества эритроцитов; поэтому как при первичных, так и вторичных анемиях •количество его находили значительно пониженным. Вообще же при различных пат. состояниях наблюдалось сравнительно мало изменений в содержании калия. Больше придавалось значения соотношению между калием и кальцием. Килин и Мирман (Kylin, Myhrman) находили величину кое- ■фициента -^"iirit
ПР
И эссеш1Иальной гипертонии равной 2,08—2,97, между тем как в норме колебания лежат между 1,70 и 2Д5. (См. также
Обмен веществ, минеральный.) Определение по Крамеру и Т и с д а -лю (Kramer, Tisdall). Метод основан на осаждении калия азотистокислым кобальтом в виде комплексной соли K
3Na[Co(N0
2)
e] . 6Н
20 и последующем ок-сидимётрическом титровании осадка раствором марганцовокислого калия.— О бработкаК. К.или сыворотка ее освобождается от белков прибавлением трихлоруксусной к-ты или сжиганием. В мерительную колбу емкостью в 50
см3, содержащую около 25cju
3 дважды перегнанной воды, прибавляют точно отмеренное количество К. (5—10
см3 ) и 2—3 капли ок-тилового алкоголя (для предохранения от вспенивания). К гемолизированной К. медленно при постоянном перебалтывании добавляют 12—13
см3 12%-ной трихлоруксусной к-ты. Минут через 10 доводят до метки и фильтруют. Берут нек-рую отмеренную часть .полученного фильтрата, высушивают в тигле досуха, остаток извлекают
и/
10 раствором НС1 и доводят объем до 10
см3.—Зола двух-трех
см3 сыворотки или К. многократно извлекается малыми порциями дважды перетканной воды при перемешивании палочкой; водные вытяжки последовательно сливают через маленький ■беззольный фильтр в мерительную колбочку емкостью в 5—10
см3 и доводят до метки. В водную вытяжку переходят лишь щелочные соли. Можно (менее удобно) вести определение непосредственно в сыворотке или фильтрате после осаждения белков, не подвергая их озолению. В дальнейшем определение калия ведется в определенной порции содержимого колбочки.—Реактивы. 1) 25 г кристаллического азотнокислого кобальта растворяют в 50
см3 воды и к раствору прибавляют 12,5
см3 ледяной уксусной к-ты; 2) 120
г NaN0
2, не содержащего калия, растворяют в 180
см3 воды; 3) ко всему количеству раствора(1)прибавляют 210
см3 раствора (2) и через смесь просасывают воздух до удаления окрашенных паров, обладающих характерным запахом окислов азота. Реактив сохраняют на холоде <не более месяца), перед употреблением фильтруют. 4) Приблизительно 4п раствор H
2S0
4; 5)
w/
10O раствор Na
2C
20
4; 6)
п1м раствор KMn0
4; 7) 50%-ный раствор NaNO
B. Ход определения. В центрифужной лробирке к 1
см3 жидкости, полученной после обработки К. или сыворотки или плазмы, прибавляют 0,5
см3 воды и 0,5
см3 раствора NaN0
2 (7); после перемешивания добавляют сначала 2
см3 воды, а затем по I каплям 2
см3 кобальтового раствора (3), хорошо перемешивают и через 45 мин. центрифугируют. Жидкость осторожно декантируют, приливают по стенке пробирки 5
см3 воды, смешивают с остатком жидкости над осадком, не взбалтывая последнего, и снова центрифугируют. Промывание 5
см3 воды и центрифугирование повторяют 3—4 раза. Затем к осадку приливают 2
см3 раствора КМп0
4 (6) и 1
см3 раствора H
2S0
4 (4), перемешивают палочкой и нагревают в кипящей водяной бане 1—1
у2 мин.; при этом розовая окраска должна еще сохраниться (если появится при более продолжительном нагревании бурый оттенок, анализ испорчен). В теплый раствор приливают 2—3
см3 раствора Na
2C
20
4 (5) и титруют избыток его раствором КМп0
4 (6) до появления слаборозовой окраски.—Р а счет. 1
см3 njim раствора КМп0
4 = 0,071
мг К. Из израсходованного количества
и/
во раствора КМп0
4 вычитают 0,03
см3, нуягаых для придания слаборозовой окраски такому объему чистой воды, каков был объем жидкости при титровании; разность умножают на 2 (чтобы число
см3 n/so раствора перевести в число
см3 п]1<10 раствора), вычитают число потраченных
см3 "/то раствора Na
2C
20
4 и полученную разность умножают на 0,071. Найденный результат перечисляют на 100
см3 крови. Натрий. В общей концентрации катионов К. 90% приходится на долю натрия, большая часть которого находится в соединении с С1. Содержание NaCl в К. человека—от 560 до 600
мг%. Кровяные тельца содержат 50—60% NaCl плазмы. Т.к. содержание С1 в К. человека около 350
мг%, то эквивалентное количество Na в К. должно составлять около 230
мг%; содержание же Na в К. в среднем равно 330—340
мг%. Следовательно небольшая часть Na находится в К. в других соединениях, гл. обр. в виде NaHC0
3 и частью вероятно в соединении с белками. Изменения содержания Na в К. наблюдались сравнительно мало. Отмечается понижение Na в К. при растительной диете. Колориметрическое определение натрия по Барреншену и Мессине р. Натрий осаждается в виде комплексной соли: уксуснокислого уранила, цинка и натрия [(U0
2)
s ZnNa (СН
3СОО)
9.9Н
20]. Для колориметрического определения натрия пользуются реакцией уранила с желе-зистосинеродистым калием: K
4Fe(CN)
e+ (U0
2) (CH
3COO)
2 =(U0
2) К
2Ге (CN), + + 2СН
3СООК. При этом получается стойкое красно-коричневое окрашивание. Одновременно с исследуемым раствором та же реакция проделывается и со стандартным раствором.—Р астворыг 1) 10
г уранил-ацетата и 6 в 30%-ной уксусной к-ты растворяют при подогревании в 50
см3 дестилированной воды; 2) 30
г уксуснокислого цинка и 3 г 30%-ной уксусной к-ты растворяют при подогревании в 50
см3 воды; 3) оба раствора смешивают теплыми и через день фильтруют; 4) стандартный раствор NaCl (0,254
г химически чистого прокаленного NaCl растворяют в воде, добавляют 1
см3 хлороформа и доводят водой в мерительной колбе до 1.000
см3; 1
см3 раствора=0,1
мг Na); о) насыщенный раствор уксуснокислого цинкав спирте; 6) 20 %-ный раствор железистосинеродистого калия.— Ход определения. В градуированную центрифужную пробирку из иенского стекла вводят 0,9
см3 дестилированной воды и приливают 0,1
см3 крови; пипетка несколько раз споласкивается полученным раствором. Для осаждения белка и неорганического фосфора, мешающих определению, прибавляют 3
см3 насыщенного спиртового раствора уксуснокислого цинка (5), оставляют стоять 1—2 мин. в стаканчике с горячей водой. По охлаждении, если произошло испарение, добавляют до первоначального объема 96%-ным спиртом и центрифугируют или фильтруют через сухой фильтр. Теперь одновременно обрабатывают полученный фильтрат и стандартный раствор хлористого натрия; 2
см3 фильтрата ( = 0,05
см3 крови) и 1
см3 стандартного раствора вводят в две разные центрифужные пробирки толстого иенского стекла. К стандарту прибавляют 3
см3 96%-ного спирта. В обе пробирки прибавляют по 2
см3 раствора уксуснокислого цинк-уранила (3) и прибавлением 96 %-ного спирта (ок. 1,2
см3) доводят в опытной пробирке концентрацию алкоголя до 50 %. Оставляют стоять 30 мин., центрифугируют, отсасывают спирт возможно полнее (как описано выше при определении Са) и прибавляют 3 си
3 50 %-ного спирта, тщательно обмывая стенки пробирок. Такое промывание повторяется 3 раза. К желтому осадку прибавляют 0,5
см3 разведенной уксусной к-ты и немного воды. Растворы количественно переносят в мерные колбы на 50
см3 и дополняют до метки водой. Прибавляют 0,5
сма •20 %-ного раствора железистосинеродистого калия, тщательно размешивают и через 3 минуты колори-метрируют. ■—-Расчет производится по формуле -~
2 • 200
мз %, где Н
2—высота столба в стандартном
-"1 растворе, Н,—в анализируемом. Магний. Содержание магния в кровяной сыворотке человека 1,6—3,5
мг%. В противоположность Na и К двухвалентный магний находится в крови лишь частью в виде легко диссоциирующей соли. Кешни (Cushny) находил в ультрафильтрате кровяной сыворотки коровы лишь половину всего количества Mg. Нефильтрующаяся часть находится вероятно главным образ, в соединении с белками. Действие магния в общем сходно с действием кальция; по в противоположность кальцию он обладает особым свойством действовать угнетающе на нервные приборы скелетной мускулатуры. Определение по Гадиенту. Из сыворотки после удаления кальцин магний осаждается в виде фосфорнокислой аммонийномагниевой соли. В осадке колориметрически определяется фосфор, по количеству к-рого вычисляется Mg.—X од определения. Для осаждения кальция в центрифужную пробирку вводят 2
см3 плазмы или сыворотки, прибавляют 3
см3 дестил. воды, 1 еж
3 3 %-ного раствора щавелево-аммониевой соли. Через 30 мин. центрифугируют, 5 см
3 совершенно прозрачного цен-трифугата (=1,6
см3 плазмы) вводят в центрифужную пробирку, прибавляют 1
см3 2%-ного раствора фосфорнокислого аммония, 2
см3 20 %-пого раствора аммиака, тщательно перемешивают стеклянной палочкой, ставят на 5 мин. в водяную баню при 80° и оставляют накрытой на сутки; центрифугируют, прозрачную жидкость по возможности декантируют (как при определении Са в К.), приливают 2
см3 2%-ного раствора аммиака, центрифугируют и такое промывание повторяют еще 2 раза. Осадок растворяют в 0,5
см3 норм, раствора H
2S0
4 при подогревании. Полученный раствор переливают в мерительную колбу емкостью в 25
см3, доводят водой до черты и определяют колориметрически количество фосфора. При вычислении найденное количество фосфора сле-
24>з
дует умножить на —-■■- = 0,784, для того чтобы получить количество Mg. Хлор (С1) в плазме находится целиком в ионизированном состоянии; однако это не исключает возможности того, что небольшая часть ионов С1 адсорбирована белковыми телами. По Гамбургеру и Нассе (Hamburger, Nasse), ионы хлора вследствие полной проницаемости кровяных телец для них могут передвигаться из плазмы в тельца и наоборот, изменяя т. о. содержание С1 в плазме. Увеличение напряжения ССу в К. вызывает переход ионов С1 из плазмы в эритроциты, а уменьшение напряжения С0
2—обратный процесс. Т. о. ионы хлора до нек-рой степени регулируют щелочность К., освобождая или связывая основания плазмы. Количественно С1 в К. значительно превосходит все другие анионы. Снайпер (Snapper) дает для сыворотки 360—380
мг% и для эритроцитов 130—160
мг%, причем он предполагает, что содержание хлора в сыворотке и эритроцитах почти одинаково, если принимать в расчет только эндогло-булярную жидкость без стромы эритроцитов. Артериальная плазма всегда содержит больше С1, чем венозная (по Brunetti, на 12
мг%). Многие исследователи отмечают колебания в содержании О в плазме после приема пищи. При мышечной работе изме- нения в содержании С1 в К. непостоянны. Определение хлоридов в К. не имеет особого клин, значения в виду того, что скопления их в крови обычно не происходит, т. к. при задержке хлоридов в организме они вместе с водой переходят в ткани. Чаще всего колебания содержания С1 в К. должны быть отнесены скорее за счет сгущения или разжижения К., нежели за счет истинной гипер- или гипохлоремии. Анба-ром (Ambard) был предложен коефициеыт, указывающий на соотношение между количеством хлоридов в моче и в крови; но практического значения этот коефициент не получил. При нефрозах (с отеками) иногда понижается количество хлористого натрия в К., между тем как при интерсти-циальном гломерулонефрите оно может повышаться. Количество хлоридов бывает понижено при диабете (сахарном и несахарном), лихорадке, пневмонии (перед кризисом однако количество хлоридов повышается); при анемии оно также понижено.— На высоте пищеварения наблюдается понижение хлоридов в крови; одновременно замечается повышение количества бикарбонатов в К. (см. также
Обмен веществ минеральный). Определение хлоридов по Прикла-довицкому и Аполлонову.—Реактивы:
i)n/im раствор NaCl (0,5846
г химически чистого сухого NaCl растворяют в 1 л дважды перегнанной воды); 2)
П/
1(М; раствор AgNO,; титр устанавливается по
п/100 раствору NaCl (1) с индикатором К
2Сг0
4; 3)
и/
1(0 раствор К J+ J
2: в 20
см3 воды растворяют 0,83
г KJ, прибавляют 0,2 г иода и добавляют воды до 5 00
см3; титр устанавливается перед каждым титрованием по AgN0
3 (2): 2 см
3 «/юо Раствора AgN0
3, 0,05
см3 HNO
s(l:3),3—5 aw
3 воды, 3—4 капли водного раствора крахмала вводят в колбочку и титруют раство.ром иода (3) до слабого синего окрашивания; 4) азотная к-та в разведении 1:3; 5) насыщенный раствор КМп0
4; 6) раствор глюкозы; 7) водный раствор крахмала.—X од определения. В Эрленмейеровскую колбу емкостью в 25—35
см? помещают
2—3
см3 воды и 0,1
см3 К. или плазмы. Пипетка споласкивается несколько раз находящейся в колбе жидкостью. Прибавляют 2
см3 (для К.) или 1
см3 (для плазмы) раствора HN0
3 (4), 2
см3' w/
100 раствора AgN0
3 (2), нагревают на .песчаной бане до кипения, прибавляют 15—20 капель насыщенного раствора КМп0
4 и кипятят 10—12 мин. После кипячения прибавляют, слегка встряхивая, по каплям раствор глюкозы до обесцвечивания. По охлаждении содержимое колбочки фильтруют, ополаскивая колбочку и промывая .фильтр 3 раза водой (3
см3). К совершенно прозрачному фильтрату прибавляют 3—4 капли раствора крахмала и титруют избыток AgN0
3 раствором иода (3) до появления слабого синего окрашивания.—В ы ч и с л е -ние: количество Q1 в
мг% = [А—
(В—0,01)]355, где
А—количество
см3 прибавленного раствора AgN0
3, В—количество cw
3 раствора иода, израсходованного на обратное титрование избытка AgN0
3, 0,01
см3— поправка на окраску. Бикарбонат-ион HCOg. Среднее содержание в плазме и венозной крови равно 0,15% НСОз; в норме количество его подвержено значительным колебаниям в зависимости от содержания С0
2 в К. (см.
Буферные свойства крови) и значительно понижается при ацидозе. Фосфор в К. содержится как в жидкой части, так и в форменных элементах. Наиболее богаты фосфором форменные элементы. Абдергальден предложил различать три фракции фосфора в К.: 1) фосфор липоидов, 2) фосфор протеинов и 3) неорганический фосфор. Грюнвальд (Grurrwald) различает еще растворимый в к-тах фосфор, под к-рым понимается фосфор тех соединений, к-рые переходят в раствор при осаждении белков
<i97 П о л Нормальное содержание Р в
мг% у человека Общее коли- Растворенный' Неорганиче в к-тах Липойдный : О'стато'шый Мужчина Женщина Мужчина Женщина Плазма 7.7—13,8
2,4—4,3
I
1 9,8—13,0
\ 3,0—4,5 I 2 Кровяные тельца 58.5—102,7 ! 44,3—79,1 ! 3 89,0— 84,7 | 50,6—65,2 -3,8 -4,4 —8,6 3,1—8,3 5,1—7,4 6,0—9,2 13,7—20,0 14,9—19,8 0,1—1,3 0,5—1,3 38,9—75,8 42,3—59,5 К.'кислотами (напр. трихлоруксусной). Этот растворимый в кислотах фосфор включает в себя 1) неорганический фосфор и 2) фосфор органических эфиров фосфорной к-ты неизвестной еще природы (Гейбнер). Фейгль (Feigl) обозначает эту вторую часть как остаточный фосфор. В плазме и сыворотке преобладает неорганический фосфор; органически связанный (кроме фосфора липоидов) находится только в -виде следов (0,2—0,6
мг%, по Фейглю); в эритроцитах отношения обратные. При рахите количество неорганического фосфора в К. понижается, что характерно для рахита. Улучшению клин, состояния рахита предшествует повышение неорганического фосфора в К., т. ч. при терап. мероприятиях можно наблюдать их эффект по кривой неорганических фосфатов в К.-— При тетании количество фосфатов нормально; в редких случаях детской тетании без одновременного рахита находили даже повышенные количества фосфора.—-При недостаточности паращитовидных желез наблюдали повышенные количества фосфора в К. При больших переломах костей у взрослых наряду с незначительным повышением кальция в К. наблюдается довольно сильное увеличение количества фосфора в К.; оно может держаться в течение нескольких дней и до 2—-4 недель. После сращения количество фосфора постепенно падает. Как правило при отсутствии образования костной мозоли после перелома не наблюдается повышения фосфора в К. При хрон. нефритах с задержкой азотистых продуктов в К. бывает и значительное нарастание количества фосфора в К. Наряду с увеличением фосфора обычно увеличивается ацидоз (понижается резервная щелочность).—При тяжелом физ. труде обычно количество фосфора в К. повышено, при умственном труде — повышается к концу рабочего дня, но за ночь приходит в норму (Гефтер и Юделович) (подробнее—см.
Обмен веществ, минеральный,
Утомление). Зимой содержание Р в К. наименьшее, весной—наибольшее (Hess). Есть указания, что эти колебания зависят от действия ультрафиолетовых лучей.—Соединения Р в К. участвуют в углеводном обмене, оказывают влияние на интенсивность
гликолиза (см.). Определение по Ф и с к е-С у б б а р о-ву-Браунштёйну (Fiske, Subbarow). Метод основан на том, что фосфор К. образует с молибде-новокислым аммонием комплексное соединение, восстанавливающееся аминонафтолсульфоновой кислотой {эйконоген) с образованием молибденовой сини. Одновременно с исследуемым обрабатывается стандартный раствор фосфора определенной концентрации. Окраску растворов сравнивают в колориметре.—Р е а к -тивы: 1)25гмолибденовокислого аммония растворяют в 1 л воды; 2) 5
п раствор H
aS0
4; 3) раствор эйкоиогена: 15 г NaHS0
3 и 0,5 0 Na
2SO
s растворяют приблизительно в 50
см3 воды; прибавляют 0,25
г ойконогена и доводят водой до 100
см3; перед употреблением часть этого основного раствора разводят в 4 раза; 4) стандартный раствор: 383,3
мг КН
2Р0
4 растворяют в воде (в мерительной колбе на 1 л), прибавляют 20
см.3 н/ю раствора H
2S0
4 и доводят водой до метки (1
см3 этого раствора соответствует 0,2
мг Р
20
5); 5) 22 %-ный раствор трихлоруксусной
-к-ты; 6) 0,85 %-ный раствор NaCl; 7) перекись водорода (Perhydrol); 8)
п1и> КМп0
4; 9) химически чистая H
2S0
4 (удельный вес 1,84); 10) свеже приготовленная смесь из равных объемов 1-го и 2-го растворов. Эйконоген—фотографический проявитель. Раствор его должен быть бесцветным, в противном случае его очищают следующим образом: нагревают 1.000
см3 Н
20 до 90° и растворяют в ней 150 г NaIIS0
3 и 10 0 кристаллич. Na
2S0
3. К смеси прибавляют 15 г эйконогена, взбалтывают, после растворения фильтруют, охлаждают и прибавляют 10
см3 концентрир. HCI. Осадок отсасывают на Бухнеровской воронке; промывают сначала водой, затем спиртом, пока стекающий спирт не станет бесцветным. Высушивают на воздухе в темном месте и хранят в темной склянке.— Ход определения. 1. Неорганический фосфор. В центрифужную пробирку вводят 2
см3 раствора NaCl (6) и 1
см3 только-что взятой (нельзя применять противосвертывающих веществ!) К.; пипетку споласкивают несколько раз, втягивая и выпуская через нее полученный раствор. Прибавляют 1
см3 раствора трихлоруксусной к-ты (5), взбалтывают и через 10 мин. фильтруют или центрифугируют. Центрифугат (фильтрат) обрабатывают одновременно со стандартным раствором. В пробирку берут 2
см3 центрифугата, 2
см3 реактива (10), 1
см3 раствора эйконогена (3). В мерную колбу емкостью в 25
см3 вводят 2
см3 стандартного раствора (4), 2,5
см3 трихлоруксусной к-ты (5), 10
см3 раствора эйконогена (3) и доводят до метки водой. Пробирку и колбу ставят одновременно на 5 мин. в водяную баню при 37°, охлаждают и колориметрируют. Расчет производится для колориметра Аутенрита при помощи кривой, эмпирически установленной для данного клина, кюветы и реактивов; для колориметра Дюбоска—по формуле: Р
20
5 в 100
см3 крови= отсчет стандарта .16 „, .
„ _ —
мг% ; 1
мг Р
20
3: 0,437
мг Р= отсчет опыта = 1,38
мг Н
3Р0
4. 2. Растворимый в к-тах и общий фосфо р.—Для определения общего Р в Кьельдалевскую колбу вводят 0,5
см3 свеже взятой К., разведенной в 10 раз водой; для анализа растворимого в к-тах Р берут 0,25—0,50
см3 фильтрата после осаждения белков трихлоруксусной к-той. В дальнейшем анализ идет-одинаково. К содержимому колбы прибавляют 2
см3 раствора H
2S0
4 (2), бросают туда стеклянную бусинку, закрывают колбу стеклышком и нагревают на слабом огне до тех пор, пока не выкипит вся вода, после чего нагревают еще 5 мин. на сильном огне. К остывшей жидкости прибавляют 2 капли пергидроля (прямо на дно колбы) и нагревают до полного обесцвечивания, удерживающегося в течение 5 мин. Если обесцвечивание не наступило, прибавляют еще пергидроля, пока оно не наступит. После обесцвечивания исследуемый и стандартный растворы обрабатывают одновременно. В Кьельдалевскую колбу прибавляют 5,5
см3 Н
20, споласкивая стеклышко и стенки, 0,5
см3 раствора КМп0
4 (8), 2
см3 раствора молибдата (1), 2
см3 раствора эйконогена (3). В мерную колбу на 25
см3 вводят 2
см3 стандартного раствора (4), *5
см3 раствора H
2S0
4 (2), 1,25
см3 раствора КМп0
4 (8), 5
см3 молибдата (1), 5
см' раствора эйконогена (3) и доводят до метки водой. Обе колбы ставят на 5 мин. в водяную баню при 37°, охлаждают и колориметрируют.—Расчет
я п п„ „ отсчет стандарта. 320 „. для общего P:P.OjbK. =-----------------
^-^----------■
мг%. отсчет опыта Сера. Данные о нормальной и пат. концентрации в К. сульфатов не однородны; исследований мало, и определения производились б. ч. в золе, где часть сульфатов образуется при сжигании серы белков. Гейбнер и Mefiep-BnHj(Meyer-Bish) находили в диализате сыворотки свободную серную и эфиро-серную к-ты ок. 19
мг% в норме (в том числе 6—8
мг% в виде эфиросерной) и до 42
мг % в пат. случаях. Лёпер (Loeper), Оливье (Olivier) и Тонне (Tonnet) установили соотношение между количеством серы серной кислоты и общим количеством серы: 80% S приходится на серу окисленную и 20% S—на т. н. нейтральную. Это соотношение изменяется в сторону уменьшения окисленной серы при заболеваниях печени, в то время как нейтральная сера остается неизменной. Нейтральная сера повышается при Аддисоновой б-ни в связи с образованием в организме пигментов, содержащих большое количество серы. Общее количество серы повышается при поражении почек, сопровождающемся азотемией (см.
Обмен веществ, минеральный). Определение сульфатов по мето-д у Геббарда (Hubbard), видоизмененному Век-фильдом (Wakefield). Принцип: сульфаты осаждают раствором бензидина, осадок растворяют в НС1, к полученному раствору добавляют перекиси водорода и хлорного железа и затем колориметри-руют, сравнивая развившуюся желтую окраску с окраской аналогично обработанного стандартного раствора хлористого бензидина. Необходимые реактивы:!) стандартный раствор: а) 2,0071
г хлористого бензидина растворяют в 500
см3 0,2 п раствора IIC1; 1
см3 этого раствора эквивалентен 1,5
мг сульфата; б) разведением раствора «а» 0,2п соляной к-той готовят стандартные растворы, 1
см3 к-рых эквивалентен: 0,15; 0,03; 0,015
мг сульфата (SOJ); 2) 20%-ный раствор свободной от сульфатов трихлоруксусной к-ты; для очищения к расплавленной трихлоруксусной к-те добавляют раствор бензидина (на 100
сма к-ты—5
см3 0,5%-ного раствора бензидина) и перегоняют под уменьшенным давлением; дестилят свободен от сульфатов и от бензидина; 3) перекись водорода (продажный Perhydrol), свободная от сульфатов; перед употреблением разводится 1:5 дест. водой; 4) 0,5%-ный водный раствор РеС1
3, не содержащего сульфатов; 5) чистый ацетон (очищение перегонкой); 6) 0,5%-ный раствор бензидина в ацетоне; появление желтой окраски— признак негодности реактива.—X од определения неорганических сульфатов в кровяной сыворотке. После свертывания К., собранной в сухую пробирку, центрифугируют и набирают 3
см3 сыворотки в центрифужную пробирку емкостью в 15
см3, добавляют 3
см3 воды, .3
см3 20%-ной трихлоруксусной к-ты и доводят водой до 15
см3. Перемешивают и центрифугируют в течение 5 минут; 5
см3 прозрачного центрифугата (С) переносят в другую центрифужную пробирку, прибавляют 10
см3 раствора (6) и закрывают пробкой во избежание испарения ацетона. Спустя не менее
1/3 часа центрифугируют в течение 30 минут со скоростью 3.000 оборотов в минуту. Жидкость сливается, причем от остатков ее освобождаются, опрокинув пробирку на сухую фильтровальную бумагу на 3 минуты. Вытерев край пробирки, в нее наливают 15
см3 чистого ацетона. Размешав осадок тонкой стеклянной палочкой, пробирку закрывают пробкой и вновь центрифугируют 15 минут с прежней скоростью. Слив жидкость и вновь опрокинув пробирку на сухую фильтровальную бумагу, вытирают через 5 мин. края пробирки и добавляют 2
см3 nU раствора НС1. Если осадок не растворяется при встряхивании, пробирку слегка подогревают, не доводя жидкости до кипения. По охлаждении добавляют 6
см3 воды, по 1
см3 растворов (3) и (4), тщательно перемешивают и через 5 минут колоримет-рируют, сравнивая окраску со стандартным раствором. Концентрация НС1 в испытуемом и стандартном растворах должна быть одинаковой, и обработка обоих растворов должна производиться одновременно. Наибольшая окраска, развившаяся через 5 минут, держится в течение 10 минут; прибавление как к стандартному, так и испытуемому раствору по 0,5
см3 концентрированной НС1 предотвращает быстрое ио- бледнение окраски.—Р а с ч е т. Количество
мг SO* в 100
см3 сыворотки= w. 100, где s—отсчет стандарта,
и—отсчет испытуемого раствора, w—количество
мг-S0
4, эквивалентных содержанию бензидина в стандарте. Сыворотка, содержащая большие количества сульфатов, должна быть при осаждении белков разведена больше чем 1:5. При содержании в пробе 0,06
мг S0
4 условия колориметрирования наилучшие. Определение общего количества SO% в сыворотке. После осаждения белков, к 5
cms центрифугата
(С) (см. выше) прибавляют 2 капли концентрированной НС1 и погружают центрифужную пробирку в стаканчик с кипящей водой на 15 мин. (гидролиз)
-. По охлаждении добавляют 10
см3 реактива (6.) и дальше поступают так же, как при определении неорганических сульфатов. Найденное поэтому методу содержание в сыворотке неорганич. S04' равно 0,5—
1,8 мг%, общего количества SO/— 2,3—4,5
мг %. Определение по Дени (Denis). В фильтрате после осаждения белков К. или плазмы получают осадок BaS0
4, количество к-рого определяется нефелометрически.-—Р а с т в о р ы: 1) а> 0,5437
г K
2S0
4 растворяют в 1 л воды; б) 10
см3 раствора (а) смешивают с 90
см3 воды (1
см3 содержит 0,01
мг S); 2) 5
г HgCl
2 растворяют В 100
см3 воды;
3) 1
г ВаС1
2.2Н
20 растворяют в 100
см3 воды; к полученным растворам 2 и 3 добавляют по 0,5
см3 НС1 (удельного веса 1,125); 4) 1 %-ный раствор (NH
4)N0
3.— Ход определения. 5
см3 крови, сыворотки или плазмы смешивают с 5
см3 n/
10 HC1 и прибавляют 5
см3 раствора сулемы (2), 0,3
г HgCl
2 в порошке, перемешивают и спустя час, в течение к-рого смесь часто и энергично встряхивают, фильтруют через беззольный фильтр; 5
см3 прозрачного фильтрата смешивают с 1
см3 раствора (NH
4) NO» (4) и 4
см3 раствора ВаС1
2 (3).—Д ля стандарта берется 10
см3 K
2S0
4 (1), 10
см3 раствора сулемы (2), 4
см3 раствора (NH
4)N0
3 (4), 1
см3 раствора ВаС1
2 (3). Через 10 мин. после помутнения растворы сравнивают в нефелометре.— 1,5=.иг S в 100
см3 К. отсчет опыта Иод находится в К. в минимальных количествах: от 0,002
мг % до 0,013
мг %. По данным Фейля (Veil) в норме содержание иода в К. человека довольно постоянно, индивидуальные колебания незначительны; до 65% J находится в виде органических соединений и 35%—в виде неорганических. Летом содержание иода выше, чем зимой. Введение per os 0,5
г вызывает через
1г/2 часа повышение до 1
мг%, постепенно приходящее к норме в течение 24 часов. Инъекции адреналина и атропина повышают содержание иода, а пилокарпина и холина—понижают. Гипертиреозы протекают с повышением концентрации иода в К. После стру-мектомии количество иода в К. понижается параллельно с понижением основного обмена. При менструациях и в последние месяцы беременности бывает гипериодемия. При б-нях К. (пернициозной анемии, лейкемии) наблюдается гипериодемия (Veil u. Sturm) (см.
Обмен веществ, минеральный). Определение иода в К. Метод Фел-ленберга (Fellenberg). Принцип. После озоления К. иод, находящийся в золе в форме иоди-дов, экстрагируется алкоголем. Алкогольный экстракт еще раз озоляется, и иод в водном растворе золы или колориметрируется после выделения его смесью серной к-ты с нитритом или титруется после перевода его в иодат. Этим методом могут быть определены количества иода в 0,1—0,3
v. (1
v=10~*b). Бром. Содержание в К. человека— около 0,5—1,5
мг% (Gautier, Bernhardt и Ucko).—Алюминий, кремневая к-та, роданистый водород, мышьяк, литий, цинк, медь, свинец, серебро, марганец были обнаружены в крови в виде следов. Железо находится в К. в виде органического соединения в молекуле НЬ. Содержание его в К. =50—60
мг%. Колебания
70£ содержания железа идут параллельно с изменениями НЬ. Нормально в сыворотке нет железа; по Иоллесу и Эрбену (Erben), при тяжелых гемолитических анемиях обнаруживаются в сыворотке следы железа; этого не наблюдается при хлорозе и лейкемии.
Определение железа по Бергману. К минерализованной К. прибавляются роданистый аммоний и ацетон. Растворы окиси железа дают тёмнокрасную окраску с раствором роданистого аммония: FeCl, + 3 (NH4) CNS = 3NH4C1 + Fe(CNS)3. Параллельно обрабатывается стандартный раствор. Реактивы: 1) приблизительно 34 %-ный раствор НВг; 2) и/10-ный раствор КМп04, не содержащий железа; 3) химически чистый ацетон; 4) стандартный раствор железа [а) 4,3557 г сухого химически чистого ГеС1з.6Н20 растворяют в воде, доводя до 1 л; б) 1 см3 раствора а разводят до 100 см" водой (в 1 см3— 0,009. мг Fe)]; 5) 5п (38 %-ный раствор NH4CNS; 6) *7io раствор НС1.—X од определения: в пробирку вводят 2 см3 Н20 и 0,04 см2 крови; пипетка споласкивается полученным раствором. Прибавляют 0,2 см3 nl10 HC1 2 см3 п[10 КМп04 и ставят пробирку на 2 минуты в кипящую баню. Образуется бурый осадок. Прибавляют 2 капли НВг (1) и снова ставят в кипящую баню на 2 мин. Осадок растворяется: если жидкость не прозрачна, прибавляют еще каплю НВг и подогревают. Жидкость фильтруют через уплотненный беззольный фильтр в узкий мерный цилиндр емкостью в 20 см3. Фильтр осторожно промывают Н20, пока уровень жидкости в цилиндре не дойдет до 5 см3. В другой цилиндр той же емкости наливают 2 см3 раствора хлорного железа (4 б), такое же количество капель НВг, как в первый, ставят на 4 мин. в кипящую баню, после чего доводят до 5 см3. В оба цилиндра по возможности одновременно вводят по 5 см3 раствора (NH4)CNS (5); перемешав, добавляют по 10 см3 ацетона (до 20 см3); еще раз смешав, закрывают цилиндры пробками и через 5 мин. колориметрируют. Колориметрическое отечи-тывание должно производиться быстро, чтобы ацетон не испарился.—Р а с ч е т. К. взято 0,04
см3. Количество железа в стандарте — 0,018
мг. Разведение К. и стандарта одинаково, количество Fe в К.= Н
2. 0,018.100 Но. 45 =-----
й--гт;-----=
—~—
> гД
е Н
2—отсчет стандарта, xlj . 0,04
Hi Н,—отсчет опыта.
Вода. Содержание воды в К. зависит от многих факторов: процессов обмена в тканях, выделительной функции почек, испарения воды, концентрации белка в К., связывания воды коллоидами плазмы, рода питания, вида и возраста животного. Несмотря на это содержание воды в К. при физиол. условиях относительно постоянно. О содержании воды в К. различных животных см. таблицу Абдергальдена, приведенную выше. 06 определении содержания воды в К., о колебаниях в ее содержании—см.
Гидре-мия, а также
Обмен веществ, водный.
Экстрактивные вещества К. делятся на две основные группы—азотистые и безазотистые. К первым относятся мочевина, аминокислоты, мочевая к-та, пурин овые основания, креатин, креатинин, аллантоин, карбаминовая к-та, гипуровая к-та, индикан, а также аммиак. Азот, входящий в состав всех перечисленных .веществ, часто определяется суммарно—в фильтрате, полученном после осаждения белков К., и объединяется под общим названием небелкового или остаточного азота К. (RN). В RN крови входят также в небольшом количестве альбумозы, пептоны, серому коид и протеиновые к-ты. В зависимости от способа, применяемого для осаждения белков К., количество RN будет различным; в нормальных условиях для К. человека содержание остаточного азота равно: по BaHrv—■ 19—39
мг%, по Фолину(РоНп)—28—42
мг%, по Гетлеру и Бекеру (Gettler, Baker) — 30 — 45
мг%, по Геммету (Hammett) — 35,6
мг%.—Различные вещества, азот к-рых входит в состав т. н. остаточного азота, содержатся в нормальной К. в следующих количествах: мочевины—19—32
мг% (N ее составляет Va всего остаточного азота К.);. аммиака—0,02—0,03
мг%, аминокислот — 6—7
мг%; креатина—3—7
мг%; креатини-на—1—2
мг%; мочевой к-ты—2—3
мг %; индикана—0,025—0,082
мг%. К общей величине N следует прибавлять около 2
мг азота, приходящегося на долю фосфатидов. Нек-рые вещества, напр. мочевина и др. составные части остаточного азота,входящие также в состав мочи, являются лишь конечными продуктами обмена, подлежащими выведению из организма; часть же аминокислот служит питательным материалом для клеток и тканей. Мочевина распределяется приблизительно поровну между плазмой и эритроцитами, аминокислоты же и NH
3 в большем количестве содержатся в форменных элементах.—При нарушении межуточного обмена в К. возрастает фракция аминокислот. По количеству RN в К. нельзя судить 0 задержке RN в тканях, т. к. между указанными величинами часто нет параллелизма;; наиболее богаты RN мышечная ткань, а также селезенка. Соединительная и особенно жировая ткани содержат ничтожное количество' RN. Увеличение количества RN наблюдается при различных пат. процессах, особенно при поражениях почек: больше всего-при далеко зашедших нефросклерозах, при острых гломерулонефритах, а также при отравлении сулемой, двусторонних кистах почек, рефлекторных и механических анури-ях и в особенности при
уремии (см.) азоте-мического типа. Задержка азотистых продуктов в К. наблюдается также вследствие экстраренальных причин. Так, при поражениях сердечно-сосудистой системы содержание RN может быть слегка повышено. При жел.-киш. расстройствах, сопровождающихся рвотой и поносами, вследствие сгущения крови, а также при кишечной непроходимости наблюдается повышение RN. Оно встречается также при лихорадочных процессах, пневмонии, свинцовом отравлении,. которое часто сопровождается поражением почек, диабете, острой желтой атрофии печени и ряде др. заболеваний, сопровождающихся усиленными процессами тканевого распада (аутолиз). Количество RN находили пониженным при нормальной беременности (см. также
Обмен веществ белковый,
Нефрит, Нефр0СКЛер03).Ю. Гефтер, С. Северин. При определении RN К. ее следует предохранять от свертывания препаратами щавелевокислых солей (Na
2C
20
4; КаСаО^ Li
2C
20
4) в количестве около 20
м& на 10
см3 крови. Освобождение от белков, которое необходимо при различных анализах крови, может быть произведено различными способами. 1. П о Ф о-л и н у. Реактивы: 1) 10%-ный раствор воль-фрамовокислого натрия (Na
2W0
4.2H
20). Препарат должен легко растворяться в холодной воде и не должен содержать большого количества карбонатов. На 10
см3 приготовленного реактива при титровании должно итти не больше 0,4
см3 и/
10 раствора НС1 (индикатор фенолфталеин); 2)
2/
8 и раствор H
2S0
4.— Осаждение: к порции К. (5—-10 сл*
3), гемолизированной добавлением 7-кратного объема. воды, в склянке емкостью 100—150
см3 добавляется 1 объем реактива (1) и по каплям при постоянном помешивании 1 объем реактива (2). Тщательно пеп реболтав, оставляют стоять 5 мин. Цвет свернувшегося белка меняется от тёмнокрасного к темнокорич-невому. Если это не происходит, то свертывание белка произошло неудовлетворительно (обычно вследствие избытка прибавленного оксалата). Анализ удается иногда спасти осторожным прибавлением 10%-ного раствора H
2S0
4 до прекращения вспенивания и до появления коричневой окраски (перебалтывание после добавления каждой капли). Полученную смесь фильтруют через сухой фильтр, обратно выливая на фильтр первые порции фильтрата.—2. По Бенедикту и Ньютону (Benedict, Newton). Реактивы. 1) Раствор молибденовокислого натрия: 25
г молибденовой кислоты (химически чистой) кипятится с 125 ом
3п раствора NaOH, пока не наступит практически полного растворения. Полученных! раствор фильтруют, фильтр промывают 100
см? воды и охлажденный фильтрат доводят водой до 500
см3. 2) 0,4 п раствор H
2S0
4- Для осаждения белков употребляется заранее приготовленная смесь из равных объемов реактивов 1 и 2.—О саждение: 1 объем крови <5—10
см3) гемолизируется добавлением 7 объемов воды; к полученному, раствору добавляют 2
см3 смеси реактивов 1 и 2, встряхивают и фильтруют.— 3. По Шенку (Schenk). Реактивы. 1) 5 %-ный раствор HgCla, 2) 2%-ный раствор НС1.—О с а ж д е- . н и е. К 1 объему К. добавляют 1 объем воды и 2' объема растворов 1 и 2, тщательно взбалтывают и спустя несколько часов (не более 24) фильтруют. В фильтрате ртуть осаждают сероводородом, от к-рого, отфильтровав HgS, освобождаются просасыванием йоздуха. Полученный фильтрат можно концентрировать выпариванием в вакууме при слабокислой реакции.—4. ПоМихаелису и Рона. Осаждение. Разбавив К. 10—15-кратным объемом воды, добавляют 5 %-ный раствор коллоидной гидроокиси железа (из расчета на 1
см3 К. 4
см3 раствора гидроокиси) и несколько
см3 10%-ного раствора MgS0
4 (можно также прибавить 0,1—0,2
г MgS0
4 в порошке). Смесь тщательно встряхивают (2—3 мин.) и, дав постоять 10 мин., фильтруют. Если полученный фильтрат еще окрашен (содержит НЬ), то следует вновь добавить раствор гидроокиси железа для окончательного осаждения следов белка. Полученный прозрачный фильтрат, подкисленный уксусной к-той, может быть сгущен выпариванием, под уменьшенным давлением. Для удаления белка из сыворотки или плазмы нужны меньшие количества гидроокиси железа: на 1
см3 сыворотки 1
см3 раствора гидроокиси железа.—5. Трихлоруксусной к-т о й (10— 20%-ным раствором). К гемолизированной К. добавляется при постоянном перебалтывании раствор трихлоруксусной. к-ты в таком количестве, чтобы конечная концентрация трихлоруксусйой к-ты была не меньше 2,5% (напр. в мерительную колбу емкостью в 50
см3, содержащую 25
см3 воды, помещается 8
см3 К.; при постоянном перебалтывании добавляется 12—13
см3 12 %-ного раствора трихлоруксусной к-ты и доводится водой до метки). От вспенивания предохраняют добавлением октилового алгоколя (1 капля).—6. П о Бангу. Реактивы. В фарфоровую чашку помещают 10 г фосфорномолибденовокислого натрия, 10 г Na
2S0
4 и 150
см3 воды; добавляют 15—20 капель 25 %-ного раствора NaOH и кипятят в течение 15 мин. По охлаждении- содержимое чашки полностью переводят в двухлитровую мерительную колбу, ополаскивая несколько раз чашку водой, добавляют 30
г (16
см3) концентрированной H
2S0
4, 0,5
г глюкозы и доводят до метки водой.— О саждение. Бангов-•ской бумажке (см.
Банга микрометоды), пропитанной 100—120
мг К., дают подсохнуть на воздухе •(около 5 мин.), затем помещают ее в пробирку, куда наливают реактив Банга в таком количестве, чтобы он полностью покрыл всю бумажку. Через 1 час содержимое пробирки фильтруется. Пользуясь реактивом Банга, можно конечно осаждать белки К. и не набирая последнюю на бумажку.—7. От белков К. можно освобождаться также ультрафильтрацией. Наибольшие величины для RN К. получают, пользуясь для осаждения белков трихлоруксусной к-той, наименьшие—применяя фосфорновольфрамовую к-ту. Различие составляет около 2
мг на 100
см3 К. Это количество N обозначается как пептидный азот.—В фильтрате, свободном от белков крови, азот органических соединений и аммиака определяется по Кьельдалю (см.
Кьель-даля способ). Методы определения остаточного азота. 1. Метод Банга. Образовавшийся NH
S улавливается титрованным раствором к-ты (См.
Кьельда-ля способ). Избыток к-ты в приемнике определяется иодометрическим или ацидометрическпм титрованием •<1-е точнее). Ход реакции: 3H
2S0
4 +
5KJ +
KJ03 = 3K
2S0
4 +
3H20 +
3J2 (а)
6J +
6 Na2S203 =
6NaJ + 3Na
2S
40
6 (б) Избыток в приемнике к-ты, не связанной NH
3,выделяет, как видно из уравнения (а), -эквивалентное количество свободного иода, к-рое определяется путем титрования гипосульфитом (б).—Различие в количестве
см3 гипосульфита (1 эквивалент гипосульфита соответствует 1 грамм-атому N), истраченных при титровании к-ты в приемнике после перегонки слепого опыта (контроль) с одной стороны и исследуемой жидкости—с другой, укажет на количество в последней NH
3, а следовательно и N (см.
Иодометрия).— 2. М е-т о д. Ф о л и н а- После осаждения белков К. по Фо-лину к 5
см3 фильтрата, помещенным в пробирку из иенского стекла с двумя метками (соответствующими 35
см3 и 50
см3), добавляют 1
см3 смеси для минерализации. Нагреванием на небольшом пламени содержимое пробирки доводится до кипения и кипятится до полного обесцвечивания. По охлаждении содержимое пробирки доводят водой до 35
см3, прибавляют 15
см3 реактива Неслера, центрифугируют, если нужно, и затем колориметрируют, сравнивая с окраской стандартного раствора (см. ниже).—П риготовле-ние смеси для сжигания (минерализация). К 50
см3 5 %-ного раствора медного купороса добавляют 300
см3 85%-ной фосфорной кислоты. Перемешав, добавляют 10
см3 концентрированной химически чистой H
2S0
4. Для минерализации пользуются смесью, разведенной водой (1:1). Подготовка для колориметрирования стандартного раствора. 3
см3 раствора (NH
4)
2S0
4 [0,4716
г химически чистого <NH
4)
2S0
4 в 1 л свободной от аммиака воды: 10
см3 раствора=1
мг N] набирается в мерительную колбу емкостью в 100
см3, куда добавляется 2
см3 разведенной водой смеси для минерализации, приблизительно 60
см3 воды, 30
см3 реактива Неслера и воды до метки. Реактив Неслера добавляется к исследуемому и к стандартному растворам по возможности одновременно.—Р а с ч е т:
т .0,3. .100
мг% N (Н
2—высота столба стандартного раствора при колориметрировании,Н1—высота столба исследуемой жидкости).—Приведенный расчет действителен при соблюдении соотношений, указанных для осаждения белков поФолину, и для дальнейшего хода анализа. Незначительно отличаются от метода Фолина методы Фолина и Дени (Denis), осаждающих белки метафосфорной к-той, Аселя (Acel), предлагающего работать с меньшими количествами исходного материала, Рриго и Герена (Grigaut, Guerin), осаждающих белки К. трихлоруксусной к-той, А. и Л. Палладиных, работающих так же, как иАсель, с реактивом Неслера, приготовленным по Винклеру.— 3. Метод П о д г о-р е ц к о й, усовершенствованный Энгельгардтом и Любимовой. Осаждение белков трихлоруксусной кислотой, минерализация фильтрата в Кьельдалевских колбах 50 %-ным раствором H
2S0
4 без катализатора. После сожжения в колбы Кьельдаля, содержащие—одна—минерализованную исследуемую жидкость, другая—контроль (реактивы без исследуемого фильтрата К.), добавляется по 5
см3 воды, несколько капель раствора индикатора-метилрота и 2 п раствора NaOH до нейтральной реакции. После добавления в колбы по 1
см3 раствора NaBrO и 10-минутного стояния в каждую колбу прибавляют 0,5
см3 5 %-ного раствора KJ, 1
см3 п раствора НС1, несколько капель раствора крахмала и спустя 3—4 мин. титруют выделившийся иод
иДоо раствором гипосульфита. Различие в количестве
см3 раствора Na
2S
20
3> пошедших при титровании содержимого контрольных проб (а
см3) и исследуемых
ф см3), даст представление о количестве аммиака и следовательно азота во взятой для анализа порции фильтрата. Реакции идут согласно следующим уравнениям: контрольная проба (не содержащая NH
S)—NaBrO + 2К J + 2НС1 = NaBr + Н
30 + + 2KC1+2J; анализируемая проба (содержащая NH,)—2NH, + 3NaBrO = N
2+3H
20 +3NaBr;TaK. обр. одна молекула NH
3 соответствует 3 эквивалентам, иода; 1
см3 п!г„0 раствора Na
2S
20
3 соответству- 14 008 ет-----
'—— = 0,0233
мг N. Умножая разность (а-
Ъ) см3 3x200 на 0,0233, узнаем содержание азота в исследуемой пробе фильтрата.—П риготовление щелочного раствора NaBrO: а) основной раствор: 120
см3 5 %-ного раствора NaOH, 1
см3 брома и до 375
см3 воды. При приготовлении необходимо смесь охлаждать снегом или холодной водой; б) перед анализом к 5
см3 раствора «а» прибавляют 45
см3 и/
10 раствора NaOH. А л ь б у м о з ы как составная часть небелкового азота не находятся повидимому в нормальных условиях в К. в предобразован-ном состоянии; скорее они являются продуктом обработки К. различными реактивами
7 05 (осадителями белков). При пат. условиях аль-бумозы как продукты аутолитического распада белков клеток могут появляться в К., ■особенно в случае обширных нагноений, и у родильниц. При миелоидной лейкемии часто находили альбумозы и пептоны в К.; на их присутствие указывалось также при саркоме. Мочевина, азот к-рой составляет около
х/
2 всего RN К., распределена между форменными элементами и плазмой равномерно. Количество мочевины в К. при физиол. условиях колеблется в широких пределах, достигая при интенсивной мышечной работе 70—80 % общей величины RN. Инъекция в К. адреналина, а также раздражение п. splanch-nici majoris приводит к повышению содержания мочевины. При уремии резкое повышение величины RN К. (до 0,3%) идет гл. обр. за счет азота мочевины, доходящего до ■0,2%. В К. селахий содержание мочевины доходит до 2,6%. Методы определения мочевины в К.—1. Метод Б а н г а. К. набирается на бумажки в количестве •(см.
Банга микрометоды) 100—130
мг, помещается в пробирки и извлекается смесью (1:1) абсолютного спирта и эфира в течение 5—24 часов (пробирку закрывают пробкой). Экстракт переносится в колбу Кьельдаля* бумажка еще раз извлекается смесью спирта с эфиром. После испарения спирта и эфира остаток минерализуется кипячением с серной к-той в присутствии CuS0
4, и NH
3 определяется иодометри-чески (необходим слепой опыт), как при определении ■остаточного азота (см. выше). Найденное количество N, умноженное на 2,143, указывает на количество мочевины.—2. Газометрические методы основаны на реакции между мочевиной и бромноватистой щелочью: CO(NH
2)
2 + 3NaBrO = 3NaBr + С0
2 + 2Н
20 + +N
2, причем выделяется азот, а образующаяся С0
2 поглощается щелочью. К. освобождается от белков кипячением с уксусной к-той в присутствий уксуснонатрие-вой соли, фильтрат помещается в какой-либо из аппаратов для анализа газов (ван-Слайка, Баркрофта, микроспирометр Крога), добавляется бромноватистая щелочь, после смешивания с к-рой учитывают выделившееся количество N (либо по объему либо измеряя давление, оказываемое выделяющимся азотом на манометрическую жидкость) (см. также
Резервная щелочность). Метод не особенно точен, т. к. 1) кроме мочевины с бромноватистой щелочью реагируют и другие азот-содержащие вещества; 2) не весь азот мочевины в этих условиях выделяется, вследствие чего необходимо вводить при расчетах установленный опытным путем коефициент, равный 1,08.— 3. У р е а з-н ы й метод: разложение мочевины с помощью уреа-зы и последующее количественное определени
i образовавшегося Ш
3. Реактивы. 1) Раствор у р е а-з ы: 3
г пермутита взбалтывают с 100
см3 2%-ного раствора уксусной к-ты; к-ту сливают и 2 раза взбалтывают с водой. К влажному пермутиту добавляют 5
г муки из бобов сои и 100
см3 30%-ного спирта. После взбалтывания, в течение i/
4 часа, смеси дают отстояться и фильтруют. Раствор фермента на холоду может сохраняться месяц. О пригодности раствора уреазы ■судят, определяя содержание мочевины в ее растворе известной концентрации. 2) Буферная смесь фосфатов: 69 г NaH
3P0
4+ H
aO и 179
г Na
2HP0
4+ + 12Н
20 растворяют в теплой воде и доводят водой до
1л. 3) Титрованный
n/
5o Р' а створ сернойк-ты. К некоторому объему фильтрата после осаждения белков К. (напр. 10
см3) прибавляют . 30
см3 буферной смеси, 2
см3 раствора уреазы (1) и нагревают в водяной бане при 50° 45 минут. По истечении указанного срока отгоняют образовавшийся аммиак в раствор к-ты (3) и определяют его титрованием иодометрически или ацидометрически или же колориметрически, пользуясь Неслеровским реактивом. Можно аммиак не отгонять, а определять его колориметрически в той же пробирке, где шло разложение мочевины. Аминокислоты содержатся в значительно большем количестве в эритроцитах, чем в плазме: в эритроцитах—9,5% общего количества RN, в плазме—1,5% общего количества. Различные аминокислоты адсорбируются эритроцитами неодинаково. В нормальных условиях в К. человека содер- жится 4—
S мг% азота в виде аминокислот; при пат. условиях может наблюдаться резкое повышение содержания аминокислот (например при лейкемии, отравлении фосфором, поражении печени). Для определения амино-кислот предложено несколько методов. I. Метод Банга. Бумажка, смоченная кровью, экстрагируется сначала смесью абсолютного спирта и эфира для удаления мочевины (можно брать бумажку, оставшуюся после извлечения спиртом с эфиром при определении мочевины в К. по Бангу), а затем реактивом Банга для осаждения белков. При второй экстракции в раствор переходят аминокислоты, азот которых может быть определен теми же методами, что и общий RN. П. Метод Фолина. Определение основано на цветной реакции аминокислот с 1,2,4 нафтохинонсуль-фокислым натрием.-—Р еактивы: 1) 10%-ный раствор вольфрамовокислого натрия и 2/
3 п раствора H
aS0
4 для осаждения белков; 2) стандартный раствор гликоколя: 37,5
мг гликоко-ля в 100
см3 n/
10 HC1; 3) раствор Na
2CO
s: 8,5
см3 этого раствора должны соответствовать 20
см3 п/
10 НС1 (при индикаторе метилрот); 4)
п/
10 раствор НС1; 5) свежеприготовленный 0,5%-ный раствор 1,2,4 наф-тохинонсульфокислого натрия; 6) 0,25 %-ныйспиртовой раствор фенолфталеина; 7) смесь (1:1) 50%-ной уксусной кислоты и 5%-ного раствора уксуснокислого натрия; 8) 4%-ный раствор гипосульфита (Na
2S
20j. .5Н
20). — Ход определения: в пробирки иенского стекла емкостью в 30—35
см3 набирают: в одну (I) 10
см3 фильтрата после осаждения белков К. по Фолину (см. выше), в другую ('II).1
см3 стандартного раствора (0,07
мг азота) и 8
см3 воды. Добавив в обе пробирки по одной капле раствора фенолфталеина (6), к стандартному раствору прибавляют 1
см3, а к исследуемому по каплям (3—4 капли) раствор Na
2C0
3 (3) до тех пор, пока розовая окраска обеих жидкостей не сравняется. После этого в обе пробирки приливают по 2
см3 свежеприготовленного реактива (5), перебалтывают и, закрыв пробирки пробками, оставляют в темноте на 19-—30 часов. Прибавив затем по 2
см3 уксуснокислой смеси (7) ипо
2см3 раствора гипосульфита(8), содержимое пробирок количественно переводят в градуированные цилиндры, доводят водой до метки в 25
см3, тщательно перемешивают и колориметрируют.— Ра счет: в стандартной жидкости содержится 0,07.«3N; колич. азота висследуемой Н
2.0,07
„ жидкости =-----==—
мг, где Н
2—высота столба стан-
Hi дартной жидкости при колориметрировании, Hj— высота столба исследуемой жидкости. С. Северин. Пурины находятся в К. в двух видах: 1) в виде свободной мочевой к-ты или кислой натриевой ее соли, содержащихся по преимуществу в плазме, и 2) в виде нуклеотидов, на долю которых приходится азота почти в 2 раза больше, чем на долю свободной мочевой к-ты. Нуклеотиды осаждаются большей частью осадите лей белков; т. о. входящий в их состав азот может не приниматься во внимание при обсуждении отдельных фракций RN крови. Колич. мочевой к-ты в норме колеблется между 1 и 3
мг% и повышается при пище, богатой клеточными ядрами или готовыми пуринами. При процессах, связанных с распадом клеток организма и их ядер, колич. мочевой к-ты К. увеличивается; при этих условиях увеличивается и выделение мочевой к-ты с мочой. Колич. мочевой кислоты часто бывает повышенным при экземе, раке, лихорадочных состояниях, хрон. свинцовом отравлении, поражении почек (в последних случаях наряду с увеличением других фракций RN). (См. также
Обмен веществ азотистый,
Мочевая кислота.) Высокие числа (до 59
мг%) для мочевой кислоты в К. находят при подагре. Тем не менее констатирование одного лишь повышения мочевой к-ты в К. недостаточно для установления диагноза подагры. При подагре отношение наибольшей концентрации мочевой к-ты в отдельных порциях
мочи к кон- центрации ее в крови значительно понижено. При пневмонии, лейкемии отношение концентрации мочевой кислоты мочи к концентрации ее в К. нормально. Определение моч-вой к-ты в крови следует производить после того, как испытуемое лицо по крайн. й мере в течение трех дней находилось
на б; спуриновой диете. ю. Гефтер, С. Северин. Методы определения мочевой к-ты принадлежат Фолину и Бенедикту; предложен также описываемый здесь комбинированный метод этих двух авторов в двух модификациях. —Реактивы. 1) 100 г вольфрамата натрия (Na2W04.2H20) растворяют в 150 си3 воды; после растворения добавляют понемногу 50 см3 85 %-ного раствора фосфорной к-ты и кипятят на слабом пламени 2 часа. В случае если раствор окращен, его обесцвечивают бромом, от н-рого освобождаются затем кипячением. Полученный раствор количественно переводят в мерительную колбу емкостью в i л и доводят водой до метки. 2) Раствор цианистого натрия (Na.CN) (15 г в 100 см3 п/?0 раствора NaOH). 3) Двадцатипроцентный водный раствор сернокислого лития. 4) Стандартный раствор мочевой к-ты. а) О с н о в н о й раствор: в мерительную колбу емкостью в 1 л помещают 1 г чистой мочевой к-ты, приливают раствор 0,5 г углекислого лития в 150 см3 воды, нагревают до 60°, пока не растворится мочевая к-та. Затем охлаждают, добавляют 25 см3 продажного (приблизительно 40%) формалина, 3 см3 ледяной уксусной к-ты и доводят водой до 1 л. Полученный раствор разливают по склянкам емкостью в 100 см3, наполняя их доверху, и закрывают пробками, которые должны быть запарафинированы. Раствор нужно сохранять в темпом месте, б) Раствор для колориметр и р о в а н и я: 1 см3 основного раствора мочевой к-ты помещают в мерительную колбу емкостью в 250 с„и3, добавляют ок. 100 см3 воды, 10 см3 */» < H2SO.., 1
см3 40%-пого формалина и доводят водой до 250 см
3. В 1 си.
3 полученного раствора содержится 0,004 .из мочевой к-ты. 5) Растворяют в воде молочнокислого серебра 5,0 г, молочной кислоты 5,0
г, прибавляют 5 см
3 10%-ного раствора NaOH и доводят водой до 100
см3. 0) Десять г Na.Cl растворяют в 0,36%-ном растворе НС1, доводя объем до 100
см'. Реактивы (5) и (6) употребляются лишь при 2-й модификации метода. Кровь для определения мочевой к-ты должна быть предохранена от свертывания щавелевокислым литием (1л
2С
гО.), а не оксалатами натрия или калия. Ход определения по 1-й модификации: в пробирки с меткой соотв. 25
см3 помещают: в одну 5 си
3 фильтрата после осаждения белков К. по Фолину (см. выше), в другую—5
см* реактива (46), содержащего мочевую к-ту (0,02
мг). В обе пробирки прибавляют по 1
см3 раствора (1), 2—4 капли раствора (3), по 2
см3 дестил. воды, по 2
см3 раствора NaCN (2) (перебалтывая) и спустя 2 минуты ставят на 70—80 сек. в кипящую водяную баню; охладив пробирки, доводят водой до метки (25 см
8) и колориметрируют.— li о 2-й модификации: в центрифужной пробирке к 5
см3 фильтрата К. прибавляют 7
см3 раствора (5), центрифугируют, отсасывают прозрачную жидкость, прибавляют к осадку 1
см" раствора NaCl (6) и размешивают; при этом мочевая к-та переходит в раствор. Прибавив 4
см3 воды и перемешав, вновь центрифугируют. Определенную, возможно ббльшую часть цен-трифугата переводят в мерительную колбу; добавляют воды до 5
см3 и дальше поступают, как при первой модификации. Расчет: во взятой для анализа порции фильтрата (при первой модификации) или центрифугата (при второй) содержится мочевой к-ты: ^ . 0,02
мг, где ■Н-1
Н2—высота столба стандартного раствора, Hj — высота столба исследуемой жидкости. Креатин и креатинин в К. распределяются между форменными элементами и плазмой повидимому равномерно (есть указания, что содержание креатина в форменных элементах выше, чем в плазме). О количеств
1 креатина и креатинина в К. можно судить по таблице Фейгля (см. ст. 708). В виду того что креатинин гл. обр. эндогенного происхождения, содержание его в К. может лучше, чем содержание моч вины, служить показателем недостаточной выделительной способности почек. Определение креатинина в К. считается важным для постановки прогноза при нефрите; случаи с коли- Кровь здорового человека натощак. Количество Креатинин в Креатин в исследований
мг% мг% (всего 50) ниже 1 ,о 6,2 1,0—1.2 6,1 1,2—1,5 7,3 1,5—2,0 6,8 выше 2,о 7,5 чеством выше 5
мг почти всегда оканчиваются летально (Meyers). Повышение количества креатинина и остаточного азота в К. не идет параллельно; незначительное повышение креатинина наблюдается при острых. лихорадочных процессах (см. также
Креатинин, Обмен веществ азотистый). Определение креатинина по Фолину. К порции освобожденного от белков и нейтрализованного фильтрата К. прибавляют половину объема насыщенного раствора пикриновой к-ты и Vio объема 10%-ного раствора NaOH. Одновременно с исследуемой жидкостью также обрабатывается стандартный раствор креатинина. Колориметрирование через 8— 10 мин. При определении общего количества креатинина (креатин + креатинин) \фильтрат после осаждения белков смешивают с п раствором НС1 в отношении 5:1 и нагревают в автоклаве втечение 20 мин. при 130° или 10 мин. при 155°. По охлаждении и нейтрализации прибавляют согласно указанной выше прописи пикриновую к-ту и едкую щелочь и сравнивают в колориметре со стандартным раствором. Стандартный раствор содержит 0,03
мг креатинина в 5
см3. Инд икай содержится в К. человека в-количестве 0,025—0,082
мг% (см.
ИнОикан, индиканемия). —Аммиак (NH
3) в норме содержится в К. в ничтожных количествах (0,02—0,03
мг%); определяя аммиак нек-рое-время спустя после взятия К., находят количество его всегда повышенным (до 2
мг%). При патологических состояниях количество аммиака может значительно повышаться (наприйер при раке, заболеваниях печени). Литературные данные о содержании; и изменениях в содержании аммиака в К. незначительны, т. к. удовле творительная методика определения аммиака была предло-ж на лишь в 1924 г. Метод Фолина и Дени. К 5
см3 окса-латной К. в Кьельдалевской колбе [рис. 16 (ст. 675— 676)] емкостью в 100
см3 добавляется 3
см3 20 %-ного раствора соды. Через полученную смесь, подогреваемую на водяной бане до 45°, протягивается воздух, увлекающий аммиак, который поглощается
n/
m раствором? серной к-ты в пробирке
в. Склянка
а содержит серную кислоту для очищеЕшн от NH
3 протягиваемого через систему склянок воздуха. В приемнике NH
3 определяется или титрованием или колориметрически реактивом Неслера. Наиболее точным способом определения NH
S в К. является метод Парнаса (Parnas). Молочная кислота при нормальных условиях содержится в крови человека в количестве 11—32
мг% (б. ч. 15
мг %). Количество молочной к-ты в К. может резко увеличиваться при интенсивной мышечной работе (до 117
мг%) (Hill), при аноксемии (как. общей, так и местной). Отмечалось повышенное содержание молочной к-ты в К. пои раковых новообразованиях и саркомах, беременности, эклямпсии (см. также
Гликолиз, Молочная кислота). Методы определения молочной кислот ы. 1. По Менделю-Гольдшейдер у (Mendel, Goldscheider). Принцип метод а: молочная к-та переводится горячей серной кислотой в ацетальдегид, дающий с вератролом красное окрашивание. Интенсивность окраски соответствует количеству образовавшегося альдегида. К гемолизирован-ной крови (1
см3 крови + 6
см3 воды) добавляют для осаждения белков 1
см3 свежеприготовленного 10%-ного раствора метафосфорной к-ты; жидкость переме- шивают; через несколько минут фильтруют и в определенном объеме (4
см3) прозрачного фильтрата осаждают углеводы добавлением 1
см3 полунасыщенного раствора CuSO. и 1
г гидроокиси кальция [Са(ОН)
3]. . Перемешав смесь, через у
2 часа центрифугируют, прибавляют к 0,5
см3 цсптрифугата (охлаждая льдом} 3
см3 приблизит. 85 %-ного раствора химически чистой H
2S0
4 (10
см3 воды и концентриров. серной к-ты до 100
см3) и нагревают на кипящей водяной бане ровно 4 минуты. По охлаждении (льдом) добавляют0,1
см3 0,125 %-ного раствора вератрола в чистом (не содержащем альдегида) алкоголе и через 20 мин. сравнивают окраску исследуемой жидкости в Аутенрита колориметре (см.
Аутенрита колориметр) с окраской клина, прокалибрированного заранее но стандартным растворам молочной кислоты. При этом методе весьма существенное значение имеет чистота и концентрация IT
2S0
4; испытывается H
2S0
4 следующим образом: 3
см3 H
2S0
4 охлаждают льдом и к ним прибавляют 0,1
см3 раствора вератрола (см. выше), причем в течение 5 мин. не должно появляться желто-зеленого окрашивания.Фирма С. A. F. Kalilba-um (Berlin) доставляет специальную марку H
2S0
4 «pro analysi acidi lactici». Эту к-ту легко заменить обычной продажной химически чистой кислотой, перегнав ее и разведя водой по приведенной выше прописи. Чистую серную к-ту нужно хранить в склянке с хорошо притертой стеклянной пробкой и оберегать от попадания пыли. 2. По Фридеману (Friedemann), К о т о н и о (Cotonio) и III а ф ф е р у (Schaffer). II р и н ц и п м е -т о д а. В освобожденном от белков и углеводов фильтрате К. молочная к-та окисляется раствором перман-ганата (КМп0
4) в присутствии сернокислого марганца до ацетальдегида, который отгоняется (при проса-сывании тока воздуха) через обратный холодильник в 1 %-ный раствор бисульфита, избыток к-рого окисляется иодом. Соединение альдегида с бисульфитом разлагается содой, после чего количество освободившегося бисульфита определяется иодометрическим титрованием. 2 грамм-атома иода соответствуют одной грамм- ■ молекуле молочной к-ты.— Реактивы: 1) приблизительно
п/ю раствор КМп0
4 (перед употреблением разбавляется в 20 раз водой); 2) раствор сернокислого марганца: H
2S0
4 285
см3, MnS0
4—100
г, дестил. воды до 1.000
см3; 3) 1 %-ный раствор бисульфита натрия (NaHS0
3); 4)
n/,
0 раствор иода; 5)
п/
10. раствор иода; 6) двууглекислый натрий в порошке (NaHC0
3); 7) 1 %-ный раствор крахмала в насыщенном растворе NaCl. В освобожденном от белков фильтрате К. (F^, соответствующем 2
см3 К., углеводы осаждают прибавлением 2
см3 8 %-ного раствора CuS0
4 и 1 г гидрата окиси кальция, перемешивают и через
11Л— 1 час фильтруют. Опред. часть фильтрата (F
2) помещают в колбу
А перегонного аппарата[рис. 17(ст. 675—676)], прибавляют 10
см3 раствора MnS0
4 (2), доводят водой до 60—75
см3, добавляют талька для равномерного кипения и соединяют колбу с холодильником
В. Делительную воронку
С наполняют
ПД
0<> раствором КМп0
4(1). Налив в приемник
D 6
см3 раствора бисульфита (3) и 10—15
см3 воды, соединяют все части прибора, пускают водоструйный насос и начинают нагревание содержимого колбы
А. Когда жидкость начнет кипеть, по каплям пускают из делительной воронки раствор KMnOj до начала выпадения осадка перекиси марганца. Закончив перегонку ацетальдегида, разъединяют колонку с бусами
Е и приемник
D, дают жидкости из колонки стечь в приемник, ополаскивают бусинки водой и приступают к титрованию. Прибавив к содержимому приемника несколько капелышди-катора (7), титруют сначала
п/
10, затем
п/юо раствором иода до слабоголубого окрашивания; добавляют теперь 0,3—0,5
г NaHC0
3 и оттитровывают освободившийся бисульфит
п/
100 раствором иода (число
см3 раствора, потраченного при последнем титровании, =
а). Описанным способом титруют также контрольную жидкость, полученную перегонкой одних реактивов без фильтрата К. (число потраченных при втором титровании
см3 ъ!1аа раствора иода = Ь).— Р а с ч е т; содержание молочной к-ты в
мг во взятой для окисления порции фильтрата (F
2) равно: (а—
Ь). .п.45
мг, где
п—нормальность раствора иода, 45
мг— количество молочной кислоты, соответствующее 1
см3 нормального раствора иода при титровании. Помимо указанных методов количественного определения различных экстрактивных веществ К. предложены также и другие.
Пигменты. Билирубин (см.
Желчь) принадлежит к нормальным составным частям К. человека и животных. Содержание билирубина в К. данного субъекта в норме очень постоянно, но индивидуально различно: от 0,25
мг% до 0,40
м'г% по данным Гиманса ван-ден Берга (Hymans v. d. Bergh) и до 1
мг% по данным Форстера (Forster). Концентрацию билирубина часто выражают в билирубиновых единицах; билирубиновой единиц' й условно называют концентрацию билирубина, соответствующую 0,5
мг его в 100
см3 растворителя. Сыворотка новорожденных содержит билирубина больше: от 1 до 3
мг%. Предельная концентрация билирубина в крови, выше к-рой наступает били-рубинурия, равна примерно
2 мг%. Увеличение наблюдается при застойной и гемолитической желтухе, пернициозной анемии, б-ни Банти, слабости сердечной мышцы. Понижено содержание при заболеваниях почек, раковой кахексии, tbc (см. также
Били-рубитмия). Определение по Гиманс ван-ден Бергу. Реактивы. 1)Диазореактив№1:5,0сульфаниловой к-ты растворяют в 500
см3 воды, приливают 50 ом
3 НС1 (уд. в. 1,19) и доводят водой до 1
л. 2) Диазореак-тив № 2: 0,5 %-ный раствор азотистокислого натрия. 3) 10%-ный раствор KCNS. 4) 0,1508 г химически чистых железоаммиачных квасцов растворяют приблизительно в 25 "см* воды, прибавляют 50
см3 концентрированной НС1 и доводят водой до 100
см3. К 10
см" полученного раствора прибавляют 2,5
см3 концентрированной НС1 и доводят водой до 250
см3, 5) Стандартный раствор: в делительную воронку вводят 3
см3 раствора (4), 3
см3 раствора (3) и 12
см3 эфира; смесь тщательно взбалтывают в охлажденной воронке и, дав отстояться, осторожно спускают водный раствор через кран воронки. Цвет эфирного раствора роданистого железа соответствует окраске раствора, содержащего 0,5
мг билирубина в 100
см3. Вместо раствора квасцов (4) можно пользоваться также раствором азотнокислого кобальта (2%). Однако эти стандартные растворы дают оттенки, отличные от получаемого в крови при действии диазореактива. Лучше поэтому пользоваться для сравнения чистым билирубином.— Ход определения. В центрифужную пробирку вводят 1
см" прозрачной сыворотки без следов гемолиза, прибавляют 2
см.3 9 6 %-ного спирта и центрифугируют. В сосуд колориметра берут 1
см3 прозрачного цент-рифугата, приливают 0,25
см* свежеприготовленной смеси из 10
см* раствора (1) и 0,2
см3 раствора (2), 0,5
см3 спирта и колориметрируют. Для вычисления количества билирубина в 100
см3 сыворотки пользуются 2,5 Но формулой: —^-----
мг; Н
2—отсчет стандарта, Н,—от- счет опыта.—О пределениепо Герцфельду. Берут серию пробирок. В первую вводят 2
см3 сыворотки, в остальные по 1
см3 воды; из первой во вторую переносят 1
см* жидкости и смешивают; из нее переносят 1
см3 жидкости в третью и т. д. Ко всем пробиркам прибавляют по несколько капель реактива Гаммарсте-на (см.
Желчь). Получается зеленое окрашивание. Концентрация билирубина в последней, содержащей еще окрашенную жидкость пробирке соответствует 0,0156
мг в 1
см3.—П р и м е р: окраска еще заметна в пробирке, где сыворотка была разведена в 4 раза. Концентрация билирубина в 100 ом
3 сыворотки= = 0,0156x4x100=6,24^8. При этом методе получаются однако слишком высокие числа. Гемоглобин нормально в плазме не обнаруживается/ переходит в нее при интоксикациях, ведущих к интравазальному гемолизу (мышьяковистый водород, нитробензол, анилин, бертолетова соль, пирогаллол). Только значительное повышение содержания НЬ в сыворотке ведет к гемоглоби-нурии, т.к. малые количества удерживаются в крови. — Гематопорфириы обнаруживайся в К. при пернициозн. анемии, острой анемии, острой желтой атрофии печени, эклямпсии, малярии, свинцовом отравлении; в норме же он отсутствует (см. также
Порфи~ рин).—Следы метгемоглобина находили при отравлении амилнитритом и бертолетовой солью, анилином, нитробензолом, пирогаллолом. — Уробилин. Применяя реактив Шлезингера (см.
Моча), часть исследователей находила уробилин в нормаль- ной сыворотке, другие' же не получали поло- I жительных реакций ни в плазме ни в сыворотке. Уробилин обнаруживается в сыворотке при крупозной пневмонии, декомпенсиро-ванных пороках, холелитиазисе (Weltmann, Loewenstein). (См. также
Уробилин, методы количественн. определения.)—Для обнаруживания уробилиногена в сыворотке применялась альдегидная реакция Эрлиха, дающая положительный результат при всех случаях крупозной пневмонии, сердечной недостаточности, острых воспалительных процессах в печени. Но Адлер и Гильген-фельдт (Adler, Hilgenfeldt) установили, что альдегидная реакция в сыворотке не специфична для уробилиногена и должна быть приписана группе триптофана белков сыворотки (см. также
Гемолиз in vivo,
Обмен веществ азотистый). — Липохромы, пигменты, придающие желтый цвет сыворотке: лютеины, ксантофил, каротин. Из сыворотки эти пигменты экстрагируются эфиром после предварительной обработки алкоголем. Содержание липохромов в К. зависит от рода питания; они являются строго ЭКЗОГенНЫМИ веществами.
С. Северин. Ферменты К. В крови найдено большое число различных ферментов. Одни из них заключаются в клетках—эритроцитах и лейкоцитах, другие содержатся только в плазме, третьи распределены как в жидкой части, так и в форменных элементах К. Дать точную количественную характеристику содержания отдельных ферментов для большинства из них не представляется возможным, т.к. при отсутствии стандартных методов количественного учета цифры отдельных авторов несравнимы между собой. Поэтому в большинстве случаев приходится говорить лишь о качественной стороне, о наличии или отсутствии того или иного фермента. О ко-. личественных изменениях, напр. при тех или иных пат. состояниях, можно судить лишь на основании сравнения исследований, произведенных по одной и той же методике. Происхождение, ферментов К. несомненно может быть весьма различным. Отчасти они являются эндоэнзимами (напр. гликолитйческий фермент), отчасти поступают в плазму К. или при распаде кровяных телец или из различных органов и тканей, отчасти м. б. всасываются обратно в К. из пищеварительного тракта (Болдырев). Их биолог, роль остается мало выясненной, и трудно сказать, какое участие они принимают в общих процессах обмена веществ. Весьма возможно, что те или иные изменения их содержания имеют не столько самодовлеющее значение, сколько являются отражением общего состояния организма, и в этом отношении определение их подчас может иметь немаловажное значение. О ферментах, принимающих участие в свертывании К.,-—■ см. ниже—-свертывание крови. Каталаза была первым ферментом, обнаруженным в К. (Thenard; 1818). Она содержится исключительно в форменных элементах, в частности в эритроцитах. Мнение, что она связана с НЬ, в настоящее время можно считать окончательно опровергнутым. Цифры для количественн. содержания ката-лазы в К. могут служить примером несрав- I нимости результатов отдельных исследователей: 1
cmz крови, по Ван-Итали, разлагает 1,08
г перекиси'водорода, по Бателли и Штерн—14 г, по Баху и Зубковой—18 г, по Иоллесу и Оппенгейму—23
г. Т. к. каталаза содержится главн. образ, в эритроцитах, то целесообразнее относить ее количество не к определенному объему крови («каталазное число»), а к определенному числу эритроцитов (van Thienen) («каталазный индекс»), или к определенному объему их(Бернштейн). Активность каталазы может частично угнетаться присутствующей в К. антикатала-зой (Штерн); действие последней может быть устранено прибавлением следов этилового спирта. — Пероксидазы в К. повиди-.мому нет, роль ее выполняется гемоглобином. Оксидаза может быть обнаружена только гисто-химически в нек-рых гранулах белых кровяных телец.— Амилаза принадлежит также к числу наиболее давно известных ферментов К. (Мажанди; 1846). Содержание ее всего выше в К. собаки, и свиньи, у человека значительно ниже. По Вольге-муту (см.
Вольгемута метод), активность амилазы К. у человека выражается
d , = 8— 32, или
В Ц1 = 10—80, т. е.. 1
см3 за 30 мин. расщепляет до исчезновения йодной реакции 8—32
мг крахмала, или за 24 часа—1—8
г; по Энгельгардту и Герчуку, при действии амилазы на крахмал за 2 часа образуется 1,85—-5,85 з редуцирующего сахара. Амилаза К. несомненно в значительной части происходит из поджелудочной железы: при перевязке протока или закупорке его (камни, опухоли) содержание амилазы в крови резко повышается, также после впрыскивания пилокарпина; последнее не наблюдается после предварительной экстирпации поджелудочной железы. Характер питания не отзывается заметным образом на амилазе. Прежние указания, что после парентерального введения крахмала содержание амилазы в крови возрастает, не нашли подтверждения в позднейших исследованиях. Обзор литературы относительно изменений амилазы при различных заболеваниях дает . Блок.—Из других ферментов, действующих на углеводы, можно упомянуть мальта-з у, встречающуюся однако не у всех видов животных. Инвертаза в норме в К. не содержится. Абдергальден находил ее после впрыскивания тростникового сахара, что однако позднейшими исследователями оспаривается. Гликолитйческий фермент, расщепляющий глюкозу с образованием молочной к-ты, содержится исключительно в форменных элементах (см.
Гликолиз).— Липа-з а (эстераза) содержится как в плазме, так ив эритроцитах, в приблизительно одинаковом количестве. Липаза К. угнетается аток-. силом (отличие от панкреатической) и хинином (отличие от липазы печени), нечувствительна к хлорал-гидрату (отличие от надпочечниковой липазы). Исследуя отношение липазы К. к указанным веществам, можно обнаружить, что при заболеваниях того или иного органа в К. появляется липаза, свойственная именно данному органу. Это удается использовать и для диагности- ческих целей. Неоднократно пытались ставить в связь содержание липазы в К. с тем или иным течением туб. процесса, считая, что этот фермент может играть роль при растворении липоидной оболочки туб. бактерий; притти к какому-либо определенному выводу на основании разноречивых данных отдельных исследователей пока не представляется возможным. Резко нарастает содержание липазы в крови под влиянием хлороформа. Эфирный наркоз таким действием повидимому не обладает. Много споров вызвал вопрос о существовании в К. протеолитических ферментов. Предоставленная сама себе К. (большая часть опытов относится к сыворотке) обычно не обнаруживает аутолиза и даже больше того—обнаруживает ясное антитрип-тическое действие. Однако аутолиз начинается, если сыворотку подвергнуть определенным воздействиям (взбалтывание с суспен-сиями крахмала, каолина, агар-агара, экстрагирование хлороформом и т. д.). Эти результаты толкуются таким образом, что в К. наряду с протеазами имеются антиферменты, тормозящие их действие. При указанной обработке антиферменты удаляются, и протеазы начинают беспрепятственно проявлять свое действие. Американские авторы приписывают антитриптическое действие ненасыщенным жирным к-там и их мылам, другие исследователи — особому физ.-хим. состоянию белков сыворотки. Помимо анти-триптического действия сыворотка обнаруживает также свойство задерживать действие сычужного фермента. Эта способность воз-' растает после парентерального введения этого фермента («антилаб» Коршуна). По Абдер-гальдену, протеолитические (точнее пептоли-тические) ферменты содержатся и в эритроцитах (расщепление глицил-тирозина). Особую группу протеаз составляют описанные Абдергальденом ферменты, появляющиеся после попадания в К. чужеродных белков и специфически расщепляющие именно данный белок. На обнаружении этих ферментов, существование к-рых в наст, время сильно оспаривается, основана т. н.
Абдергальдена реакция (см.). По Уткину-Любовцову, в К. имеются две протеазы: одна с оптимумом действия при рН = 7, другая при рН=2,5— 2,7.—Происходящее в экстравазированной К. образование аммиака обусловлено действием заключающегося в эритроцитах фермента, дезаминирующего аминопурины или их нуклеотиды и нуклеозиды (Энгель-гардт, Мосоловский). — Фосфатаза, расщепляющая эфиры фосфорной к-ты (глицерофосфаты, гексозофосфаты), содержится как в плазме, так и в тельцах. При нек-рых заболеваниях костной системы содержание этого фермента в К. может возрастать в 20 И более раз.
В. Энгепьгардт. X. Свертывание К. Свертываемость К. представляет собой свойство К. превращаться при определенных условиях в студенистую массу—кровяной сгусток, к-рый состоит из фибрина и кровяных телец, захваченных этим сгустком. Спустя нек-рое время сгусток сокращается (ретракция сгустка) и выжимает сыворотку в ви- де прозрачной, слегка желтоватой жидкости без примеси кровяных телец. Процесс свертывания сводится к образованию в К. растворимого в плазме белка—-фибриногена и к превращению его в нерастворимый фибрин. Макроскопически это сводится к желатинированию, микроскопически же (вернее уль-трамикроскопически) появляются отдельные иголочки, к-рые соединяются в густую сеть. При исследовании ультрамикроскопом процесс напоминает кристаллизацию, и некоторые авторы рассматривают процесс свертывания как кристаллизационный процесс (Stiibel). При нормальных условиях в сосудах кровь не свертывается, но при выходе ее из сосудов наступает ее свертывание. Образовавшийся сверток К. препятствует дальнейшему кровотечению. Способность К. к свертыванию следует рассматривать как приспособительную функцию организма в борьбе за существование, при к-рой травматические повреждения представляют собой обычное явление. Изучение процессов свертывания представляет большие затруднения. Нет единой методики исследования; приходится иметь дело с веществами, природа к-рых еще не выяснена, веществами, весьма мало устойчивыми. Затрудняет также отсутствие единой терминологии; одно и то же вещество у разных авторов носит различное название. Так, названия отдельных компонентов свертывания представляются в следующем виде. Фибрин у всех авторов носит одно название; фибриноген носит это название у большинства авторов; фибрин-фермент (А. Шмидт) = тромбин (Morawitz); предстадий (зимоген) фибрин-фермента = тромбоген (Моравиц) = протромбин (А. Шмидт) = плазмозим = = серозим (Бордё, Моравиц); предстадий тромбогена = =протромбоген = просерозим (Борде); тромбокиназа (Моравиц) = тромбозим +тромбопластическая субстанция (Нольф) = цитозим (Борде)=липоид. Теория свертывания К. Первые исследования по изучению свертывания К. принадлежат Денису, Бьюкенену, Вирхову (v. Denis, Buchanan, Virchow). До 1905 г. учение о свертывании крови всецело стояло на точке зрения ферментативной теории. В дальнейшем под влиянием успехов коллоидной химии пытались объяснить и механизм свертывания исключительно физ.-хим. путем, совершенно отклоняя ферментативные обоснования. Основой исследований в области свертывания К. является классич. теория А. Шмидта, который рассматривает свертывание К. как ферментативный процесс. Дальнейшее развитие эта теория получила благодаря трудам Артюса, Пажеса, Гаммарстена (Arthus, Pages, Hammarsten), установившим и необходимость присутствия солей Са для процесса свертывания; работы Моравица укрепили господствующее и поныне учение о ферментативном характере процесса свертывания крови. К его воззрениям присоединились Фульд и Спиро (Fuld, Spiro).. Эта и поныне господствующая теория рассматривает свертывание К. как ферментативный процесс. Согласно этой теории фибрин - ф е, р м е н т (тромбин) находится в. К. не как таковой, а в виде недействующего. профермента тромбогена. Для активирования тромбогена необходимы два фактора: 1) соли кальция, 2) кофермент-актива-тор, названный Моравицем т р о м б о к и н а- зой. По Моравицу, для процесса свертывания необходимы след. компоненты: 1) фибриноген, 2) тромбоген, 3) соли кальция и 4) тромбокиназа. Сторонники ферментативной теории различают в процессе свертывания 2 фазы: 1-я фаза—образование фибрин-фзрмента (тромбина) из его предстадия; 2-я фаза — превращение фибриногена под влиянием тромбина в нерастворимый фибрин. Образование тромбина представляет сложный процесс, в к-ром принимают участие многие факторы. Для образования тромбина из находящегося в плазме тромбогена необходимо действие тромбокиназы (образуется при распаде главным образом кровяных пластинок), которая переводит тромбоген в протромбин, переходящий в присутствии ионов Са в а-протромбин. Последний под влиянием зимопластических веществ, образующихся при распаде клетки при условии соответствующе й активной реакции среды, дает тромбин. При выхождении К. из сосудов происходит повреждение клеточных элементов крови, образуется тромбокиназа. При взаимодействии тромбокиназы (зимопластических веществ), тромбогена и ионов кальция образуется активный тромбин, под влиянием к-рого происходит переход фибриногена в фибрин. Непосредственно для перехода фибриногена в фибрин присутствие солей кальция не является необходимым. Внутри сосудов кровь не свертывается, т. к. нет тромбокиназы. Количество тромбокиназы, образующейся в циркулирующей К. вследствие распада клеточных элементов, настолько незначительно, что не может оказать влияния на свертываемость, т. к. ее действие нейтрализуется наличием в К. веществ, препятствующих евзртыванию. Кроме того действие тромбина, образующегося в циркулирующей крови, не проявляется в виду наличия в крови антитромбина. Для доказательства ферментативного характера тромбина Шмидт приводит целый ряд свойств, сближающих тромбин с ферментами: 1) тромбин подобно другим ферментам имеет оптимальную t° действия (37°) и разрушается при 70—75°; 2) действие его ослабевает при охлаждении; 3) для проявления его действия достаточны минимальные количества; 4) кислоты и щелочи мешают, а нейтральные соли в слабых концентрациях способствуют действию его; 5) он может быть получен свободным от белков. Гаммарстен и Оппенгиймер относят тромбин к протеазам и, по Оппенгеймеру, действие его напоминает сычужный фермент. В более новое время вопрос о свертывании К. рассматривают и с точки зрения коллоидно й х им и и. Согласно этому учению свертывание'представляет собой в конечном результате коллоидный процесс. Фибриноген находится в плазме в коллоидном растворе. Все процессы, к-рые уменьшают дисперсность, уменьшают растворимость фибриногена и ведут к появлению нерастворимого фибрина. Впервые эта теория была выдвинута Вулрнджем (Wooldridg
5). Он указывал, что тромбин является не причиной свертывания К., а продуктом ее. Нольф рассматривает процесс евзртывания как взаимное осаждение трех коллоидов, находящихся в К. в лябильном равновесии. Состояние равновесия удерживается благодаря регулирующему влиянию антитромбозима. При нарушении же равновесия наступает свертывание. Вещества, способствующие свертыванию, называются тромбопластическими. К ним в широком смысле относятся все предметы, к-рые могут нарушать неустойчивую систему: например стеклянная пыль, уголь, стенки стеклянных сосудов, коллоиды различных степеней дисперсности. Черезтром-бопластические вещества устраняется анти-тромбозическое влияние, и наступает свертывание. Нольф отмечает, что и в норме в К. ультрамикроскопически наблюдается появление нежных нитей фибрина, но вследствие протеолитического действия тромбозима они быстро исчезают. Тромбоген и тромбозим действуют вместе на фибриноген и создают с одной стороны фибрин, с другой — тромбин. В зависимости от количества каждого из трех компонентов, участвующих в процессе свертывания, результаты различны. В К., где фибриногена много, образуется исключительно фибрин, в жидкостях же, где фибриногена меньше, чем тромбогена, неиспользованный тромбозим и тромбоген, соединяясь, образуют тромбин. Т. о. по теории Нольфа тромбин является не причиной свертывания, как это предполагают сторонники ферментативной теории, а побочным продуктом в результате свертывания. Гекма (Hekma) рассматривает фибриноген как растворимое щелочное соединение фибрина. По его мнению фибрин есть обратимый гель фибриногена, а фибриноген—золь фибрина. В основе процесса лежат явления гидратации и дегидратации. Свертывающее действие тромбина основано на его способности адсорбировать щелочи. Итак Гекма дает этому сложному процессу простое коллоидо-химическое объяснение;'для фермента не остается места. Однако экспериментальными наблюдениями этого доказать не удалось. В дальнейшем Гекма изменил свой взгляд на механизм действия тромбина и полагал, что свертывание под влиянием тромбина происходит благодаря его способности вызывать склеивание частиц фибриногена; Гекма стал рассматривать тромбин как аглютинин. Но процесс свертывания нельзя сравнивать с процессом аглю-тинации, к-рый проявляет свои специфические коагулирующие свойства не склеиванием, а другим путем. Цак (Zak) выдвинул значение липоидов К. для свертывания ее. Обезжиренная плаз?ла не обладает способностью свертываться даже при наличии готового тромбина; прибавление липоидо-содержащих вчц ств возвращает ей снова способность свертываться. Липоиды Цак отождествляет с киназой. Если оставить в стороне теорию Нольфа, к-рая защищает совершенно особые взгляды, то все авторы сходятся в том, что процесс свертывания крови состоит в превращении раствори-могов плазме белковоготела—фибриногена— в нерастворимый фибрин под влиянием тромбина. В вопросе же о характере и сущности влияния тромбина взгляды разных авторов р
сзко расходятся, и вопрос и в наст, время не может считаться окончательно решенным. В последнее время появилась новая теория свертывания, объясняющая этот процесс с совершенно новой точки зрения. Штубер и Ланг (Stuber, Lang) указывают, что во время свертывания К. исчезает сахар в К. и образуется молочная кислота, к-рую они считают причиной свертывания. Они полагают, что в основе процесса свертывания лежит не специфически свертывающий, а гликолити-ческий фермент, и действие его не является непосредственным. Выпадение фибрина наступает по пути гликолиза. Чем быстрее образуется молочная кислота, тем быстрее наступает свертывание.—По вопросу о месте образования необходимых для сверты-зания веществ (фибриногена, тромбогена и тромбокиназы) тоже нет единодушия взглядов. Местом образования фибриногена часть авторов считает костный мозг (J. Mtil-.ler, Morawitz), другая—печень. Есть указания, что фибриноген образуется почти во всех органах и тканях. Последние работы американских авторов указывают на связь между функцией рет.-энд. системы и количеством фибриногена в К. Тромбоген образуется в костном мозгу из форменных элементов крови, в первую очередь из кровяных пластинок; из них же образуется и •тромбокиназа. Ант и тромбин, как полагают .одни, образуется в печени, другие это оспаривают. О происхождении и хим. природе протромбина мы знаем очень мало. Процесс перехода протромбина в тромбин в наст, время остается также невыясненным. Определение скорости свертыва-н и я К. можно производить как с венозной, так и с капилярной кровью. Первое дает более точные данные, т. к. исключает примесь тканевой жидкости, •сильно отражающейся на процессе свертывания. Но т. к. прокол вены является препятствием для частых исследований, то на практике чаще пользуются исследованием капилярной К.— Определение ц о, Б ю р к е р у. В углубление предметного стекла помещают каплю прокипяченной (для удаления С0
2) дестил. воды и туда же выпускают каплю К., добытую уколом из хорошо вымытого кончика пальца. Момент взятия крови отмечается на часах. Спустя
а1г минуты вводят в каплю тонкую стеклянную палочку с маленьким шариком на конце и, сделав несколько (5) спиралеобразных движений, вынимают палочку, захватив часть К. Так повторяют каждые
у2 минуты, пока при вынимании палочки из К. не покажется первая нить фибрина, что и считается началом свертывания. К. здорового человека при исследовании по этому способу свертывается в 5—б'Д мин. Исследование производится в специальном приборе, дающем возможность производить исследование при постоянной t°. Прибор состоит из водяной бани, к-рая наполняется водой в 25°. В центре крышки имеется углубление, выложенное металлом; в это углубление вставляется предметное стекло с исследуемой кровью. Вследствие того что стекло лежит на металле, хорошем проводнике тепла, соприкасающемся с водой, исследование происходит при одинаковой t°. Определение свертываемости по Мае и Магро (Mas, Magro). Укол в тщательно вымытую мякоть пальца, первую каплю удаляют и новую каплю насасывают в капилярную трубку •вместимостью в 20
мм3 (пипеткой, приложенной к гемометру Сали), предварительно смоченную изнутри парафиновым маслом. Каплю К. выдувают в парафиновую каплю, помещенную на часовое стеклышко, также смоченное парафиновым маслом. Этот момент отме-■чается как начало исследования. Каждые две минуты выпущенную каплю К. вновь насасывают в пипетку. До начала свертывания К. насасывается легко, после наступления свертывания насосать ее невозможно. В норме при этом способе К. свертывается через 8—12 мин.— О пределение по Фонио (Fonio) сводится к измерению способности К. преодолевать действие веществ, мешающих свертываемости. В качестве тормозящих свертываемость веществ автор пользуется растворами сернокислой магнезии различной концентрации: 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 3,5; 4,0; 4,5%. Берут К. из локтевой вены и смешивают с 0,75 %-ным раствором сернокислой магнезии в отношении 3:1 >8 см
3 крови и 2
см3 раствора соли). В штативе уста- навливают ряд маленьких пробирок (3—4
см вышины и 1 си в диаметре) и в каждую отмеривают но 0,2
см3 кровяной смеси и по 0,05
см3 раствора сернокислой магнезии в постепенно возрастающей концентрации. В первой пробирке остается первая кровяная смесь. Штатив накрывается для предохранения от пыли и оставляется на 2 часа при комнатной t°, после чего отмечают свертывание. В первой пробирке сверток абсолютно плотен; отмечают ту пробирку, в к-рой свертывание неполное, и ту, в которой имеются лишь отдельные свертки. Для решения вопроса о нарушении свертываемости необходима проверка растворов на нескольких образцах нормальной К.—В СССР наибольшее распространение имеет исследование свертываемости по способу Ситковского при помощи коагулометров, представляющих различные видоизменения предложенного им прибора (Егоров). При помощи этого прибора удается производить исследование при одинаковой t°. Прибор состоит из стеклянного сосуда, в к-рый наливается вода, подогреваемая спиртовкой до определенной t°. В сосуд через отверстия в пробке вставлены термометр и пробирка. Пробирка боковым ответвлением при помощи резиновой трубки соединена с манометром. Манометр с другой стороны соединен резиновой трубкой с резиновой грушей. К., полученную уколом в тщательно вымытый кончик пальца, насасывают в капиляр до определенной метки (1—2
см вышины), отмечают на часах момент взятия крови,- капиляр с К. через резиновую пробку опускается в пробирку, погруженную в сосуд с водой. Вода предварительно подогревается до t° тела и все время поддерживается при данной t°. При помощи винта нажимается резиновая груша, и воздух вгоняется в пробирку, в к-рую погружен капиляр с К. Увеличенное давление, отмечаемое на манометре, поднимает столбик К. в капиляре, и он двия;ется вверх и вниз. Пока свертывание не наступает, стенки капиляров остаются чистыми. Вызывая, нажиманием на грушу через каждые
у2 минуты движение столбика К.в капиляре, отмечают момент прилипания кусочков крови к стенкам сосуда как начало свертывания. Концом свертывания считается момент, когда при давлении в 30
мм ртути столбик крови остается неподвижным. В нормальной К. начало свертывания по этому методу наступает через 1,5—2 минуты, конец—через 2—4 минуты. Изменения свертываемости К. под влиянием различных условий. Свертываемость К. у нормального здорового человека меняется в зависимости от целого ряда условий. Так, время свертывания К. укорачивалось после приема пищи (Mills). Темп, оказывает сильное влияние на скорость свертывания. Низкая t° у теплокровных замедляет, у холоднокровных ускоряет свертывание К. Оптимальной t° для свертывания у теплокровных животных является t° тела. На свертывание оказывает влияние целый ряд физиол. факторов: обмен веществ, функции эндокринного аппарата, условия изотонии, изоионии и т. п. Громадное значение в процессе свертывания имеют ионы кальция. Есть указания, что двухвалентные катионы влияют гл. обр. на образование тромбина, способствуя этому в слабых концентрациях и задерживая в сильных; анионы задерживают свертывание. Состояние резервной щелочности также оказывает влияние на свертываемость. Баумбергер (Baumberger) указал, что с увеличением бикарбонатов замедляетсясвер-тывание К., а с увеличением напряжения С0
2 в К. свертывание ускоряется. Реакция среды также оказывает влияние на свертываемость: кислая реакция благоприятствует свертыванию, а щелочная мешает-ему; малые дозы адреналина (0,001
мг на 1
кг веса) ускоряют свертывание, а большие дозы замедляют. Экстракты гипофиза (задней и передней доли) действуют различно на свертывание: экстракты задней части ускоряют свертывание, передне й—замедляют. При кормлении кроликов щитовидной железой получается замедление свертывания (Schiakawo, Sasaki). При перевязке выводных протоков поджелудочной железы получается увеличение содержания фибриногена в крови и одновременно замедление свертывания К. Под влиянием ультрафиолетовых лучей свертывание крови in vitro замедляется. Данные о влиянии ультрафиолетовых лучей in vivo противоречивы. Наблюдениями Стефана (Stephan) установлено, что при рентгенизации селезенки значительно повышается способность К. к свертыванию. На основании этих данных Стефан придает селезенке центральное значение в регулировании механизма свертывания. Указывая на благоприятный терап. эффект, получаемый от рентгенизации селезенки при патол. изменении свертываемости, Штубер оспаривает участие селезенки при процессе физиол. свертывания К. Считаясь с фактом ускорения свертывания К. при рентгенизации селезенки, нек-рые авторы рекомендуют профилактически производить рентгенизацию селезенки при сложных операциях, сопровождающихся опасными кровотечениями. Есть указания на связь свертываемости К.с проблемой иммунитета. Фукс и Фалькенгаузен (Fucbs, Falkenhausen) указывают на идентичность протромбина с комплементом. Они отмечают, что все анти-тромбические вещества, замедляющие свертывание, одновременно замедляют действие комплемента; косвенно это подтверждается и тем фактом, что комплемент можно заменять протромбином и наоборот. Плазма, из которой удален протромбин, не обладает ни свертываемостью ни комплементом. Оба возвращаются, если прибавить протромбин. Lunz и 1а Вахте сообщают важные данные 0 физиол. особенности свертываемости при анафилактическом шоке. Быстро, вскоре после инъекции развивается значительное замедление свертываемости крови. Крейс и Штрауссер (von Kreys, Strausser) нашли, что фазе уменьшения способности к свертыванию предшествует фаза увеличенной способности свертываться. Объяснить причину изменений свертываемости К. при анафилаксии в наст, время не представляется возможным. Свертываемость К. при пат. состояниях. Свертываемость К. в норме подвержена небольшим колебаниям. У взрослых (при определении по способу Ситков-ского) начало свертывания колеблется от 1 до 1,5 минут, а конец—между 2 и 4 минутами. У детей свертываемость К. такова же, как у взрослых; исключение представляют новорожденные, у которых в течение первой недели жизни свертываемость оказывается пониженной: начало 3—4 минуты, конец—до 30 минут и больше (Горницкая). При различных пат. условиях встречаются случаи, при которых К. обладает повышенной способностью к свертыванию, и тогда наблюдается образование тромбов; в других случаях при пониженной способности свертываться наблюдается сильная кровоточивость. Чаще в патологии встречают заболевания, сопровождающиеся замедлением свертываемости. Среди группы заболеваний, сопровождающихся кровотечениями, на пер- вое место следует поставить
гемофилию (см.) и псевдогемофилию. Резкое замедление свертывания является отличительным признаком этих заболеваний от группы геморагическо-го диатеза, при которой свертывание обычно не бывает изменено. Если при гемофилии отмечается резкое замедление свертывания, то псевдогемофилия отличается тем, что при ней свертывания крови совсем не наступает даже после прибавления свежей сыворотки, тканевого экстракта и т. п. Та же кровь, прибавленная к раствору фибриногена, вызывает свертывание. В плазме К, больных псевдогемофилией не удается обнаружить фибриногена; тромбин же в К. образуется, на что указывает свертывание раствора фибриногена после прибавления сыворотки псевдогемофилической крови. Об изменении' свертываемости К. — см.
Гемофилия. — При группе заболеваний, известной под именем геморагического диатеза, в громадном большинстве случаев свертываемость К. оказывается неизмененной.—Свертываемость К. оказывается замедленной при целом ряде инфекционных заболеваний: при кори и скарлатине у детей, при сывороточной б-ни, erythema nodosum (Горницкая); My— раками и Ямагуши (Murakami, Yamaguchi) находили при tbc и плеврите увеличение фибриногена и уменьшение фибрин-фермента, вызывающие замедление свертываемости. Замедление свертываемости обнаружено при злокачественных опухолях (Allen, Горницкая). При гипертиреозе свертываемость замедлена, а при гипотиреозе—ускорена. При сахарном диабете свертываемость замедлена (Цукерштейн, Горницкая). Кровотечения, наблюдаемые при холемиях, и отмеченное-при них замедление свертывания нек-рые авторы объясняют недостатком фибриногена; другие полагают, что здесь подобно гемофилии имеется медленное образование тромбина. Гартман (Hartmann) объясняет замедление свертывания при паренхиматозных поражениях печени появлением в К. большого количества веществ, препятствующих превращению просерозима (протромбогена> в серозим (тромбоген). Имеются также указания на нарушения образования фибрина и тромбина. Условия, замедляющие свертывание К. Недостаток необходимых для свертывания компонентов или торможение одной из фаз свертывания вызывают замедление или полную задержку свертывания.. К таким тормозящим свертывание моментам можно отнести понижение t°, выпадение кальция, экстрагирование липоидов, прибавление камеди, белка, гирудина, гепарина-К веществам, замедляющим свертывание, принадлежат и нек-рые алкалоиды: атропин, пилокарпин, стрихнин, холин, хинин, никотин, кокаин и др. При этом оказывается, что вещества с антагонистическим фарма-кологич. действием оказывают одинаковый эффект на свертываемость. К замедляющим свертывание веществам следует отнести желчь, хлороформ, алкоголь, эфир, хлорал-гидрат, сальварсан, верональ, формальдегид и друг. Действие этих веществ на свертываемость объясняется различно: так, замедление свертывания, вызываемое нар- козом хлороформенным, эфирным, хлорал-гидратом, объясняется действием этих веществ на печень. Действие холина объясняется тем, что он препятствует превращению про-серозима в серозим; формальдегида—разрушением фибриногена и тромбина, и т. п. Вещества, ускоряющие свертывание. Гипертонические растворы соли ускоряют свертывание. Действие их объясняется тем, что наступающая после их введения гидремия способствует попаданию в ток крови тканевых субстанций,ускоряющих свертывание. Есть указания, что введение кальция per os ускоряет свертывание; однако многие это отрицают. Эльвинг (Elving) своими исследованиями доказал, что внутривенное введение гипертонического раствора хлористого кальция является наиболее действительным средством, ускоряющим свертывание. Действие желатины при свертывании сводится может быть к действию примеси кальция. Большие дозы цитрата натрия, введенные внутривенно, вызывают ускорение свертывания. Эффект объясняется действием этой соли на пластинки, к-рые под его влиянием быстро разрушаются, причем ци-тозим попадает в плазму; у больных пурпурой с уменьшенным количеством пластинок и у уток, лишенных пластинок, эффекта от действия цитрата натрия не наблюдается. Ускоряющее действие in vivo на свертывание крови оказывают эйфилин, пиперазин,
теофилин И др. Э. Горницкая. XІ. Дыхание форменных элементов К. Если насытить цитратную кровь кислородом, разделить ее на две порции и одну из них поставить на лед, а другую—в термостат без доступа воздуха, то спустя несколько часов можно заметить, что первая порция сохраняет свой первоначальный яр-коалый цвет, а вторая более или менее значительно темнеет. Причиной этого является восстановление оксигемоглобина в НЬ вследствие потребления части 0
2 форменными элементами К.: эритроцитами, лейкоцитами и кровяными пластинками; количество это может быть точно измерено и достигает у здорового человека за 5 часов 10% первоначального количества 0
2. Если произвести тот же опыт с дефибринированной нормальной кровью, в к-рой пластинок нет вовсе, а количество лейкоцитов значительно понижено, то потеря 0
2 падает до 3—4% за 5 часов (0,6—6,8 Vol %). Из этого количества приходится на лейкоциты около 0,1 Vol% на каждую 1.000; за вычетом потребленного ими кислорода остается 0,2—0,4 Vol % 0
2 (1 -—2% первоначального количества), представляющие собой потребление 0
2 эритроцитами здорового человека (т. н. редуцированная цифра). Нередко эта цифра падает до нуля, вообще же лежит почти в пределах ошибки исследования, т. ч. говорить о потреблении 0
2 нормальными эритроцитами человека можно лишь весьма условно Значительно больше потребление 0
2 у собак—7—14%, по Денеке (Denecke), и у кроликов-—-около 15%, по Варбургу (Warburg); гусиная кровь (ядросодержащие эритроциты) может потерять уже за первый час до 60% своего кислорода (Варбург). Но и у людей потребление кислорода эритроцитами может быть резко повышенным: это явление наблюдается при анемических состояниях различного происхождения, где потребление кислорода достигает 20—40 и более процентов. Потребление 0
2 эритроцитами было впервые обнаружено Моравицем и Пратом (Morawitz, Pratt) в 1908 году; одновременно было установлено, что исчезновение 0
2 сопровождается образованием соответствующего количества С0
2 (Моравиц, Варбург), а в 1923 г. Денеке выявил и параллельно протекающий процесс гликолиза, причем все эти явления имеют место не только в присутствии кровяной сыворотки, но и в отмытых эритроцитах, взвешенных в солевых растворах (Варбург, Денеке). Таким образ. потребление 0
2 оказывается проявлением истинного дыхательного процесса в самих эритроцитах. Т. к. зрелые эритроциты здоровых людей 0
2 почти не потребляют, а в эксперименте наблюдается значительное нарастание потребления 0
2 после кровопусканий и еще большее при введении гемолитических ядов, вызывающих разрушение эритроцитов, сопровождающееся, как известно, особенно интенсивной регенерацией К., то-Моравиц уже в первых, работах по этому вопросу пришел к заключению, что потребление 0
2 зависит от циркулирующих в К. «юных» эритроцитов, отличающихся от вполне зрелых ясно выраженным дыхательным обменом. На этом основании он уже тогда предложил пользоваться этим способом для определения интенсивности регенерации К. В дальнейшем к этой точке зрения примкнули и все остальные исследователи в этой области. Что касается того, какие эритроциты отличаются усиленным дыханием, то уже с самого начала было ясно, что Это не только ядросодержащие тельца, к-рые могут даже вовсе отсутствовать при усиленном поглощении О
а кровью; усиленное дыхание связано очевидно с морфологически неразличимыми остатками ядерного вещества, не успевшими еще полностью рассосаться. Эти вещества и были выявлены Мазингом (Ma-sing) путем определения нуклеин-фосфора в молодых эритроцитах. С другой стороны некоторую роль играет несомненно и более сложная структура протоплазмы незрелых телец (см.
Дыхание тканевое), проявлением к-рой служит ретикуло-филаментозная субстанция. Однако изменения обоих этих факторов дыхательного процесса (ядерного вещества и структуры протоплазмы) протекают не всегда вполне параллельно друг другу; следствием этого является отмечаемое некоторыми исследователями отсутствие параллелизма между потреблением 0
2, зависящим преимущественно от состояния ядерного вещества, и другими морфол. илифиз.-хим. признаками незрелости эритроцитов, зависящими от состояния протоплазмы (поли-хромазия, витальная окраска). По этой же причине ни один из этих признаков не может вполне заменить определения степени потребления О
а эритроцитами. К сожалению довольно кропотливая техника исследования мешает внедрению его в клинику. Техника исследования. Из локтевой вены набирают 10—15
см3 К. в сосуд, содержащий стеклянные бусы. Путем осторожного взбалтывания К. дефибринируется; прилетом из нее удаляются все •бляшки и значительная часть лейкоцитов. Дефибрини-рованная кровь фильтруется через стерильную марлю в Эрленмейеровскую колбочку и насыщается кислородом путем осторожного взбалтывания на воздухе в течение 15 минут, после чего часть ее наливается в колбочку со стеклянной бусинкой, плотно закрывается лритертой пробкой (следить, чтобы в колбочке не осталось пузыря воздуха) и ставится на 5 часов в термостат при 38°. По истечении этого срока путем многократного осторожного перевертывания колбочки добиваются равномерного распределения осевших эритроцитов, колбочку открывают, возможно быстрее добывают со дна ее 1
см3 К. и опускают под гемолизирующий раствор (0,5%-ный раствор аммиака со следами сапонина) в специальный сосуд из аппарата Баркрофт-Голдейна. Из крови, не поставленной в термостат, точно так же гемолизируют 1
см3 тотчас по насыщении 0
2. Определение 0
2 производится с железосинеро-дистым калием поБаркрофт-Голдейну. Разность между содержанием 0
2 в обеих порциях К. показывает потребленное количество его, из к-рого затем вычитают потребление, приходящееся на долю лейкоцитов (не забыть подсчитать лейкоциты в дефибринированной крови!). Расчет производится следующим образом: в насыщенной К. найдено 0,185
см3 О
г, в вынутой из термостата—0,167
см" 0
2, лейкоцитов в 1
мм3 дефибринированной К.—4.000. Потребление 0
2 эритроцитами равно: 0,185—0,167—0,004 (лейкоциты) = 0,014 с.и
3= = 7,6 %.—Необходимым условием точности результатов является стерильность посуды (дыхание бактерий)
и полный гемолиз К. в аппарате.
Я. Черняк. XІІ. Патология К. Болезней: крови в буквальном смысле этого слова повидимому не существует, т. к. во всех случаях, относимых нами к б-ням К., всегда в той или иной форме участвуют и органы кроветворения; поэтому правильнее говорить не о б-нях К., а о б-нях К. и кроветворных органов. При решении вопроса о механизме развития этих б-ней возникают впрочем и до настоящего времени спорные вопросы,—какие процессы (в крови или в кроветворных органах) являются первичными и какие вторичными, т. к., внося изменения в состав К., мы обычно получаем и изменения в органах кроветворных, а с другой стороны изменения в последних обычно дают те или иные «картины крови». Т.о. гемопатии и миелопатии (аденопатии) являются тесно координированными процессами. Из этого, разумеется, не вытекает, что констатирование тех или иных пат. изменений в К. всегда указывает на соответствующие картины в костном мозгу (или в лимф, железах) и, обратно, что изменениям органов кроветворения всегда соответствуют определенные картины крови. (О возможных причинах такого несоответствия см. выше, а также
Кроветворение.) Клиническое и морфол. исследование б-ней К. показывает далее, что и данное вышз рпсширительное толкование ■болезней К. нуждается в коррективах в смысле дальнейшего расширения морфол. и фнкц. базы этих болезней. Так, при некоторых болезнях К. в пат. процесс втягиваются кровеносная и лимф, системы, лежащие за пределами кроветворных органов, часто втягивается вообще соединительная ткань, где бы она пи находилась. Иногда- картину болезней К. и кроветворных органов дополняют страдания других систем, напр. пищеварительного тракта, нервной системы (напр. злокачественное малокровие), причем здесь возникают трудности и по вопросу о патогенезе заболевания в том смысле, что изменениям именно этих систем многие пытались придавать основное значение. Наконец в ряде случаев не подлежит сомнению, что «болезни крови» являются отражением болезней других систем организма (метаста-зирование рака в костную систему, инфекционные лейкоцитозы и миелозы, лейкемоид-ные реакции при разных страданиях и т. д.). К б-ням крови обычно относятся следующие заболевания:
Анемия, Лейкемия, Лимфогранулематоз, Полицитемия, Агранулоцитоз, Алейкия, Гемофилия, Гемолитическая туха, Верльгофова болезнь, Лимфосаркома, Миелома (СМ.). и. Давыдовский. XІІІ. Кровь детей. Кровь человека отличается периодической изменчивостью своих физ. свойств и хим. состава. Эти изменения находятся в зависимости от различных факторов внешнего и внутреннего характера. Одним из таких факторов служит возраст человека, т.к. обмен веществ, физ .-хим. свойства клеток и анат.-физиол. константы организма обнаруживают довольно значительные отличия в отдельные возрастные периоды. Наиболее резкое отличие в строении и функции организма вообще, а в физ .-химических свойствах К. в частности, наблюдается у детей грудного возраста, т. е. до 1 г. (см.
Грудной ребенок). Этот период жизни человека характеризуется особенностями питания, обмена и деятельности регулирующих органов, в частности эндокринной системы. На первый план здесь выступает резкая лябильность водного обмена, интенсивность процессов ассимиляции и размножения клеток, относительная недостаточность ферментативно-окис-лительных функций. В связь с этим следует поставить больший объем у грудных детей кроветворной ткани (красный костный мозг трубчатых костей, внекостномозговые очаги кроветворения) и более резкие колебания тонуса кровеносных сосудов. Последнее может быть у детей причиной более значительного различия в составе К. отдельных областей тела, чем у взрослых. В послед, возрастные периоды влияние возраста отступает на второй план, а на свойства К. начинают постепенно оказывать большее влияние другие факторы, как-то: индивидуальность ребенка в смысле конституции и условия среды. Однако, учитывая закономерность изменений свойств К. в связи с характером обмена веществ в организме и зная особенности обмена для отдельных возрастных групп, имеется возможность устанавливать в каждом конкретном случае зависимость найденных величин от возраста ребенка. Физ. свойства К. детей. Удельный вес К. в период от рождения до 1 года выше, чем у взрослых, равняясь 1.060—-1.070; на 2-м году уд. в. падает и в дальнейшем держится на цифрах 1.055—1.050. Отмечают более высокий уд. в. крови у мальчиков. Вязкость К. детей значительно выше, чем у взрослых: после рождения— 10,6—-11,4, к началу 2-го месяца-—6,3, а до 1 года средней цифрой считается 3,8. Свертываемость крови у новорожденных повышена в течение первой недели жизни по сравнению со взрослым в 2—3 раза; в дальнейшем, начиная со 2-й недели, разли- чие быстро исчезает, и свертываемость К. мало изменяется даже при заболеваниях. Исключение составляет корь, дающая во время инкубации резкое понижение свертываемости. Свертываемость К. у недоношенных детей резко замедлена, доходя в первую неделю до 30 мин. (по методу Ситковского-Егорова), а затем повышаясь к концу 2-й недели до 1—2 мин. (начало) и 3—4 мин. (конец свертывания) (Самсонова). По данным Ме-лентьевой свертываемость К. у здоровых детей до 1 года измеряется 45—55 сек. (начало) и 2 мин. 10 сек.—2 мин. 12 сек. (конец). Реакция оседания эритроцитов (S. R.) у новорожденных до 8 дней замедлена, давая от 0 до 0,5
мм в 1 час; далее скорость оседания резко повышается до 14
мм, а затем устанавливается на средней цифре в 5—6,5
мм с колебаниями от 2 до 11
мм (по Балаховскому). Последние зависят от приема пищи, а резкое ускорение реакции наблюдается у детей при острых инфекциях и после подкожного введения протеинов.— Понижение точки замерзания сыворотки К. 4 у грудных детей несколько больше, чем у взрослых, т.к. интенсивное питание и обмен ведут к увеличению молекулярной концентрации крови. Для взрослых величины
Л ограничиваются—0,54— 0,59, но для маленьких детей колебания
Л выходят за эти пределы в сторону увеличения.— О бщее количество К. у грудных детей больше, чем у взрослых, составляя •около Vio веса тела, тогда как у взрослых мы имеем Vi3 веса тела. Хим. состав К. детей. Активная реакция К. детей не отличается от таковой у взрослых; рН = 7,30—7,33 (при 40
мм С0
2, по Фридрихсену). Колебания рН в сыворотке крови наблюдаются у здоровых детей в пределах 0,2—0,4 в зависимости от питания; у грудных детей наименьшие колебания дают грудное молоко и углеводы, а наибольший уклон в кислую сторону обнаруживается при кормлении мало разведенным коровьим молоком; смесь Черни отклоняет рН крови грудных детей в щелочную сторону (Маслов). Нормальное состояние кислотно-щелочного равновесия крови определяется рН, равным в среднем 7,31 при 38°, и содержанием в крови С0
2, равным 50 VoI%. Компенсированный ацидоз крови, т. е. увеличение С0
2 при том же самом рН, встречается у детей при различных условиях: 1) при кормлении неорганическими кислотами; 2) при нефрите; 3) при диабете; некомпенсированный ацидоз крови находят при анафилактическом шоке, при острой интоксикации, во время комы. При тетании у детей установлено повышение щелочности крови (алкалоз) с увеличением рН на небольшую цифру и со значительным уменьшением содержания С0
2 в К.—С ухой остаток крови составляет в первый день жизни 26% и падает на 10-й день до 23,07%. Содержание золы в 1-й день—1,1%, на 3-й день падает до 0,97% и повышается в следующие 4 дня до 1,07% и на 1.0-й день снова падает до 0,98% (Schiff). Сухой остаток ночью выше, чем днем; количество его у хорошо развитых детей выше, чем у слабых.—Б елки кровяной плазмы человека составляют 6—8%; белки сыворот- рси—7,42—9,13%; у новорожденных отмечается наиболее низкая цифра, а именно-—■ в сыворотке около 6% белковых веществ. Прием твердой пищи и введение жидкостей оказывает малое влияние на общее количество белков К., тогда как при мышечной работе оно заметно увеличивается. Гипоаль-буминозы встречаются у детей при всех ги-дремич. состояниях, наприм. при б-нях почек, при длительных кахексиях, а также при инфекц. заболеваниях, вследствие задержки в крови ISlaCl. Белковый коефициент—отношение глобулинов К. к альбумину для человека равняется в среднем 1 : 1,5 (Adler, Strauss); у новорожденных находят значительно более низкие цифры для глобулинов. Изменение коефициента (глобулин : альбумин) в сторону увеличения глобулинов наблюдается у детей при инфекционных заболеваниях, при гнойных процессах, при туберкулезе, при заболеваниях почек, во время иммунизирования вакцинами и сыворотками, при освещении кварцевой лампой. — Стабильность
коллоидов плазмы связана с увеличением не общего количества глобулинов, а грубо дисперсных белков этой фракции; наименее стабильной оказывается плазма новорожденных несмотря на малое.содержание в ней глобулинов (Sachs, v. Ottingen). Для суждения о стабильности коллоидов плазмы применяют различи, реакции, основанные на оценке легкости выпадения белков из раствора. Исследования Финкелынтейна по методу Да-рани (Daranyi) показали, что у грудных детей легкость выпадения белков из плазмы усиливается при расстройствах питания и при tbc. Остаточный азот. Цифра остаточного азота в грудном и детском возрасте является повышенной до 50
мг%. При этом распределение остаточного азота таково: мочевины—25
мг%, мочевой кислоты—3,5
мг%, аминокислот—5,5
мг%, креатинина— 1,7
мг%, креатина—6,5
мг%, аммиака 0,02-— 0,03
мг%. Т. о. увеличение остаточного азота в грудном возрасте приходится на долю мочевины. При гипотрофии, эксудативном диатезе и почечных заболеваниях величина остаточного азота К. становится еще более высокой.—Общее количество липоидов в К. детей подвергается более резким колебаниям, чем у взрослых, даже в нормальных условиях. Здесь оказывает влияние частота приема пищи, степень подвижности ребенка и состояние кислотно-щелочного равновесия крови. Лябильность всех перечисленных условий влечет за собой изменчивость в содержании липоидов в К. детей. Наибольшее число работ по липоидному обмену у детей связано с определением количества холестерина в К. По данным Розен-таль цифра холестерина у здоровых грудных детей колеблется на первом году от 0,021 до 0,035
мг%; у детей старше года доходит до 0,152
мг %; у недоносков, по Ивен-ской,—0,047—0,055
мг%. По исследованиям Тур закономерности в колебаниях цифры холестерина у детей при разных заболеваниях установить не удалось. По данным Соколовой скарлатинозная инфекция повышает количество- холестерина в К.; при этом высокая холестеринемия может зависеть от тяжести случая или от индивидуальности ребенка. При врожденном сифилисе холестерина—0,030—0,076
мг% (Ро-зенталь).—С а х а р в К. детей при нормальных условиях колеблется в тех же пределах, что и у взрослых: у грудных детей по данным клиники Федынского средняя норма заключается между 0,06 и 0,11
мг %. Опыты с нагрузкой углеводами (2,0 сахарозы на 1
кг веса) и с последующим определением содержания в К. сахара в течение 2
х/г часов каждые 15 минут дают у детей различные кривые; при этом для недоносков характерной является кривая с очень резким подъемом и спуском (крутая кривая). При пат. условиях сдвиг в сторону больших цифр дают дети ст. н. алиментарной интоксикацией, с заболеваниями септического характера и с желтухой (Федынский). Минеральные вещества К. детей. Общее количество Са в крови детей сравнительно мало отличается от величины его в К. взрослых. Для грудных детей средняя цифра Са установлена в 10,2
мг %; в венозной К. и при асфиксии несколько больше; в сыворотке здоровых детей Са колеблется, по Крамеру и Тисдалю, от 9,5 до 10
мг %, а по Котикову, от 8,5 до 14
мг %: Клинически больший интерес представляют отношения Са к фосфору К. и коефициент калий : кальций. Гьерги считает за норму такое соотношение кальция и фосфора крови, при к-ром произведение Са . Р больше 40. По данным Цимблера и Нейштадта у здоровых грудных детей Са колеблется от 9,6 до 11,6
мг%, а неорганический фосфор—от 3,75 до 5,0
мг%. У больных детей колебания Са шире: от 5,0 до 15,0
мг%, а содержание фосфора ниже 3,5
мг% считается характерным для рахита (Цимблер и Бегам). При тетании грудных детей находят уменьшение общего количества Са в сыворотке К. при относительно высокой цифре для неорганического фосфора (Гьерги).— Калий содержится в К. детей в количестве около 20
мг%, а коефициент К : Са колеблется от 1,70 до 2,15. Увеличение содержания в К. калия наблюдается при всех процессах, сопровождающихся гемолизом, как-то: при анемиях, нек-рых инфекциях, при недостаточности почек, анафилактическом шоке. Уменьшение калия в сыворотке К. отмечено при освещении кварцевой лампой (Adler).—Содержание натрия и хлоридов вК. детей несколько повышено по сравнению со взрослыми .■— Ферменты К. детей дают большие колебания. У здоровых грудных детей показатель к а т а л а з ы по методу Баха находится в пределах 14,0—18,0 г; протеаза (по Баху) в среднем ниже 3 единиц, в то время как у взрослых показатель протеазт.г 3—5.,— Амилаза в К. детей дает очень резкие колебания от 300 до 600 единиц; липаза 20—26 единиц (Скворцов, Мелентьева, Вальтер). Нек-рые авторы видят связь между силой ферментативной энергии К. детей и биол. полноценностью организма ребенка. Так, по данным Поюровской наиболее низкие показатели ферментов крови обнаруживаются у слаборожденных детей; у недоносков ферментативная энергия меньше, чем у доношенных. Колебания ферментативной энергии отмечаются у детей по дням в связи с падением или подъемом веса. Клин, интерес представляет также отношение числа каталазы к числу эритроцитов и Hb (van Thienen). У детей от 2 недель-до 3 лет индекс равняется 2,0—5,5; отношение =3,5—8,0 (Грязнова и Мелентьева). эритроциты
гемоглобин каталаза У взрослых второй индекс равен 5,4—6,8. По Маслову, различия в ферментативной энергии К. детей находятся в зависимости от их конституциональных свойств. Так, лимфатико-гипопластики отличаются пониженным содержанием каталазы, повышенным содержанием липазы и амилазы; у астеников понижена липаза и каталаза (Маслов). Техника взятия крови у детей-Здесь имеются нек-рые особенности по отношению к грудному возрасту. Для общеклинического исследования и для биохим. микрометодов К. берется из пятки или из большого пальца ножки, т. к. эту часть тела удобнее фиксировать и кроме того все манипуляции менее заметны для ребенка. Рекомендуется привозить ребенка в лабораторию в кроватке или же брать К. в палате; необходимо отмечать всякое нарушение нормального хода взятия К., чтобы принять это в расчет при оценке результатов исследования (напр. крик ребенка). В тех случаях, когда требуется несколько
см3 К., ее набирают постепенно каплями из--укола или разреза пятки или нее пунктируют одну из видимых вен головы или шеи; наконец можно у грудных детей брать К. из продольного синуса, по Тоблеру (Tobler); сбривают волосы, смазывают кожу около большого родничка иодом, вкалывают иглу длиной в 2
х/г
см и толщиной 0,7—1,0
мм в задний угол большого родничка и ведут ее параллельно коже по средней линии родничка На глубину 0,5—0,8
CM. H. Николаев.
XІV. Паразиты К. Паразиты К. локализуются в плазме, эритроцитах и лейкоцитах. В плазме К. бывают Trypanosoma gambiense, Trypanosoma rhodesiense, Trypanosoma Cruzi (в период жизни в периферической К. в трипаносом-ном стадии) и мерозоиты малярийного плазмодия (короткое время). Из плоских червей в кровеносных сосудах живут кровяные двуустки (Schistosomum); среди ленточных червей обитателей К. нет (если не считать миграции зародышей); из нематод в плазме К. живут личинки различных нитчаток: mi-crof Maria nocturna (Wuchereria Bancrofti), microi'ilaria diurna (Loa-loa), microfilaria perstans (Acanthocheilonema perstans). Зародыши трихин, выходя из кишечника, достигают мышц по кровяному руслу. В эритроцитах проходит цикл схизогонии (т. е. множественного деления) малярийного плазмодия. Животная природа описанных в эритроцитах млекопитающих и человека ге-могрегарин весьма сомнительна; таковыми являются повидимому различные растительные клетки, загрязняющие мазки крови при их изготовлении и окраске. У млекопитающих паразитами эритроцитов являются пи- роплазмы, бабезии, тейлерии, анаплазмы и •бартонеллы. В эритроцитах черепахи живет и размножается Haemogregarina Stepanowi. Karyolysis lacertarum ящериц в эритроцитах проходит стадии гаметоцит. Эндоглобу-лярными паразитами лейкоцитов являются лейшмании; у птиц там же живет Leucocyto-zoon; Toxoplasma в свою очередь поражает -лейкоциты (например Toxoplasma Gondii). Hepatozoon muris часть своего жизненного цикла проводит в плазме крови и в моно-нуклеарах (гаметоциты) крыс и мышей; в .лейкоцитах собаки, кролика и различных диких грызунов паразитируют свои виды темогрегарин.
Е. павловский. ХV. Кровь как питательная среда. Как- составная часть специальных питательных сред К. создает особенно благоприятные условия для культивирования определенных микробов, причем нек-рые виды их и растут только на кровяной среде. Будучи т. о. элективной, кровяная среда (агар) в то же время имеет диференциально-диагности-ческий характер, т. к. служит показателем гемолизирующей способности тех или других бактерий, причем выражением гемолиза служит появление зоны просветления вокруг колоний. К. берется у человека из v. mediana руки, у крупных животных (лошадь, баран, овца)—из яремной вены, у лабораторных животных (кролики, морская свинка)—непосредственно из сердца при соблюдении всех условий асептики. Если для -среды требуется большое количество К., то после тщательной дезинфекции места пункции вена прокалывается шприцем или троакаром, и вытекающая К. непосредственно собирается в стерильную, длинногорлую колбу с бусами; колбу необходимо все время •покачивать во избежание свертывания К. По окончании операции собранная К. дефибринируется тщательным взбалтыванием, после чего К. годна к употреблению. Для предупреждения свертывания крови можно пользоваться
1/2%-тшм раствором лимоннокислого натра. В других случаях К., полученная от названных животных или *от человека (из мякоти большого пальца по Schottelius'у), не дефибринируется, а прямо из шприца прибавляется к питательной среде (агар, бульон). Взятая стерильно и дефи-бринированная или особенно смешанная с
V-l2%-m>m. раствором лимоннокислого натра, К. хорошо сохраняется на леднике в течение нескольких дней. Для консервирования К. нек-рые авторы (Бернштейн, Эп-штейн, Кантани) рекомендуют прибавлять к ней небольшие количества щавелевокислого аммония, формальдегида или в равном с К. объеме глицерин (Кантани">. но все эти методы консервирования не имеют большого практического значения. Для приготовления кровяных сред употребляется главным образом обыкновенный агар или бульон, иногда с примесью сахара, глицерина и т. п. Агар расплавляется в Коховском аппарате, охлаждается до 45° и к 4—5 ч. его прибавляют 1 ч. К. Осторожным покачиванием во избежание образования пузырей агар смешивается с К. и разливается или в чашки Петри или в пробирки в виде косого агара. Для быстроты и простоты можно смазывать поверхность косого агара несколькими каплями свежей К. Иногда среда после прибавления К. подвергается нагреванию, напр. при приготовлении т. н. шоколадного агара Левинталя. Кровяной агар употребляется гл. обр. для изучения стрептококков, анаэробов и вибрионов. По Дольду (Dold), для определения гемолитических свойств стрептококков следует употреблять агар с прибавлением 5—10% де-фибринированной К. барана или лошади; среда наливается в чашки довольно тонким слоем. Для получения поверхностного роста анаэробов рекомендуется кровяной агар в чашках Петри. Элективной средой для роста вибрионов и особенно холерных вибрионов является агар Дьедонне; кровь собирается в стерильные колбы с бусами, смешивается с равным объемом нормального раствора едкого кали и кипятится 45 мин.; в плотно закрытых бутылках смесь может сохраняться в течение нескольких месяцев. К семи частям 3%-ного нейтрального агара при 45° прибавляют 3 части вышеуказанной щелоч-но-кровяной смеси и разливают в чашки. Чашки следует оставлять при комнатной t° на 24—48 часов для испарения аммиака, затем их подсушивают в термостате и засевают. Колонии вибрионов обнаруживаются уже через 10 час, в то время когда роста других бактерий кишечной флоры еще нет.— Пфейфер и другие авторы находят вообще, что НЬ может полностью заменить цельную К. и является наиболее ценной частью ее, делающей возможным рост даже такого прихотливого микроба, как Вас. influenzae; Пфейферу удалось получить концентрированный раствор НЬ из К. голубя обработкой 0,85%-ным солевым раствором, последовательными замораживаниями и оттаиваниями или вместо последних обработкой эфиром с последующим выпариванием его в вакууме при низкой t° и фильтрованием через свечу Шамберлана. Капля полученной жидкости, разведенная физиол. раствором и прибавленная к агару, делает его равноценным кровяному агару. Кровяные среды с различным содержанием К. от 10% до 70% необходимы для культур животных паразитов; для этой цели употребляется гл. образом среда Но-ви-Нил - Николя (N—N—N). Жессар предложил в качестве питательной среды кровяную плазму, к-рая получается при смешении К. с 20%-ным раствором Nad и является хорошей средой для тех исследований, при к-рых свойства живого организма и К. должны сохраняться без изменений.—Являясь с одной стороны составной частью элективных сред, К. с другой стороны может быть использована как замена мяса в питательном бульоне. По методу Саса (Szasz) следует размельчить кровяной сгусток, залить полуторным количеством дестилированной воды и оставить при частом помешивании на 24 часа; затем профильтровать через холст, кипятить, пока не выпадут хлопья и не наступит просветление жидкости, установить реакцию, прибавить пептон, соль и далее поступать так же, как при приготовлении бульона. Лангер предлагает подвергать кровяной сгусток перевариванию при тем- пературе 37° раствором панкреатина и находит такую среду очень благоприятной ДЛЯ роста Микробов.
А. Коржинская.
Лит.: Дополнение к лит., данной при ст.
Гематология — Аничков Н., Ретикуло-эндотелиальная система, М.—Л., 1930; Балаховский С, Мик-рохимич. анализ крови,М.—Л., 1930; Б а н г Г., Мик-рометодыисследования крови, Харьков, 1923; Г е р цА., Диференпиальный диагноз болезней крови, Л., 1929; Гордон 3., Клинические наблюдения над определением массы крови у больных, Труды VIII съезда российских терапевтов, стр. 523, М., 1925; Егоров А., Клетки крови, цветные таблицы, М.—Л., 1930; Известия Пермского биологического научно-исследовательского ин-тута, т. III—IV, Пермь, 1924—25 (статьи С. Алфеевой, А. Заварзина и др. по сравнительной морфологии соединительной ткани); К а л ь -м е т т А., Н э г р Л. и Б о к э А., Руководство по микробиологической и серологической технике, М.— Л., 1928; М е ч н и к о в И., Лекции по сравнительной патологии воспаления, М.—П., 1923; Пинкус-с е н Л., Микрометодика, М.—Л., 1930; Северин С, Нейтрализационная теория регуляции дыхания, Журн. эксп. мед. и биол., т. II, в. 1—2; С и м а г и -на В., О дыхании эритроцитов, Тер. арх., т. VIII, в. 3, 1930; Т а р е е в Е., Анемия брайтиков, М., 1929; Тимофеевок и й А., Патология крови, 2-е изд., Томск, 1930; III а д е Г., Физическая химия во внутренней медицине, Л., 1930 (последнее нем. изд.—Dres-den-Lpz., 1923); Шиллинг В., Картина крови, М.—Л. (печ.; с приложением указателя новейшей рус. и иностр. лит. по морфологии крови); В а а г II. u. Stransky E., Die klinische Hamatologie des Kindesalters, Lpz.—Wien, 1928; Barcroft
J-, Respiratory function of the blood, v. I—II, Cambridge, 1914—28 (нем. изд.—В. I—II, В., 1927—28); Bar-renscheen H. u. Willheim R., Die Labora-toriumsmethoden der Wiener Kliniken, Wien, 1928; В о -tazziF., Die Korpersafte, Hndb. d. vergl. Physiol., hrsg. v. H. Winterstein, B. I, S. 592—596, Jena, 1921 (лит.); Gilbert A. et Weinberg M., Traite du sang, v. Ill—IV—Donnees nouvelles sur le sang, P., 1930; Handbuch der Biochemie des Menschen u. der Tiere, hrsg. v. С Oppenheimer, B. IV—Blutu. Lymphe, Jena, 1925; Handbuch der biologischen Arbeitsmetho-den, hrsg. v. E. Abderhalden, Abt. 4, 5 u. 8, B.—Wien, с 1923; Hofmann A., Geschichte der Physiologie u. Pathologie des Blutes, Wurzburg, 1914; Oppenheimer C, Die Fermente u. ihre Wirkungen, B. I—III, Lpz., 1925—29; Ron a P., Praktikum der physiolo-gischen Chemie, T. 2—Blut, 1929; Rowntree a. Brown, The volume of the blood a. plasma, Philadelphia—L., 1929; SchleipK. u. Alder A., Atlas der Blutkrankheiten, B.—Wien, 1928; S e у d e r -helm R. u. Lampe W., Die Blutmengenbestim-mung u. ihre klinische Bedeutung, Erg. d. inn. Med., B. XXVII, 1925 (лит.).
 Смотрите также:
Смотрите также:
- КРОВЯНОЕ ДАВЛЕНИЕ, давление, которое кровь производит на стенки кровеносных сосудов (т. н. боковое давление крови) и на тот столб крови, к-рый наполняет сосуд (т. н. концевое давление крови). В зависимости от ...
- КРОВЯНЫЕ ПЯТНА, см. Вещественные доказательства. НРОГ Август (August Krogh, родился в 1874 г.), крупный современный, физиолог, профессор Копенгагенского ун-та. Многочисленные работы К. посвящены физиологии дыхания, кровообращения и ...
- КРОЛИКИ, Lepus cuniculus domesticus, грызуны сем. заячьих (Leporidae), являются одними из наиболее широко употребительных лабораторных животных (см.) и применяются для самых разнообразных физиологических, общепатологических, но гл. обр. инфекционных и иммунологических ...
- КРОЛЬ Михаил Борисович (род. в 1879 г.), видный современный невропатолог, проф. Белорусского гос. ун-та. Окончил медиц. ■факультет Моск. ун-та в 1901 г. Работал под руководством профессора Минора как ассистент в клинике ...
- КРОНЕКЕР Гуго (Hugo Kronecker, 1839— 1914), известный физиолог. Был профессором физиологии Бернского ун-та (Швейцария). Работы К. касаются разнообразнейших отделов физиологии, особенно нервно-мышечной, кровообращения, глотания. К. вместе с С. Мельцером (S. Meltzer) ...













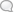 Смотрите также:
Смотрите также: