ГАЗОВАЯ ЦЕПЬ
ииюгагаидашг-
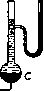
"1""'""1.........|""|1'м|иттп
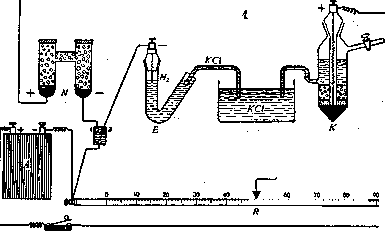
rnj— Е—водородный электрод; К—каломельный электрод; С—1;апилярный электрометр; iV—нормальный элемент; А—аккумулятор; Я—реохорд. В положении 1-м переключателей включается нормальный. элемент (JV), при помощи которого проверяют ЭДС аккумулятора (А). В положении 2-м измеряют ЭДС цепи, состоящей из водородного (£) и каломельного {К) электродов, соединенных насыщенным раствором КС1. Устройство водородной цепи. Согласно уравнению (1) ЭДС водородной цепи E=RTln {£^4 • Переходя от натураль- ных логарифмов к десятичным и подставляя числовые значения Л и Т (для 18°), находим (в вольтах): В=0,058 (log [H](2>— — log (H]fi>). Концентрацию водородных ионов принято в настоящее время выражать ее отрицательным десятичным логарифмом, получившим название водородного показателя, рН (=—logLH]). Вводя его в нашу формулу, получаем: £=0,058 (pH(i)-pH(a)) (2). Различию величины водородного показателя в одну единицу (т. е. десятикратному изменению концентрации водородных ионов) соответствует, таким образ., разность потенциалов приблизительно в 58 милливольт. Производя измерение с точностью до половины милливольта, можно определить до 0,01 рН. Водородная цепь слагается из двух половин, двух водородных электродов, погруженных в различные растворы; они являются как бы «полуэлементами», совместно дающими концентрационный гальванический элемент. Чтобы, пользуясь уравнением (2), определять в исследуемом растворе водородный показатель, последний должен иметь известную, строго определенную величину во втором растворе. Для этого можно пользоваться так паз. «нормальным водородным электродом», т. е. водородным электродом, погруженным в нормальный раствор сильной кислоты. В этом случае концентрация [ЬГ] равняется приблизительно единице, рН(„)=0, и вычисление искомого рН принимает крайне простую форму (для 18°): (3), где Е выражено в милливольтах. Хотя расчеты при пользовании нормальным водородным электродом просты, на практике оказывается более удобным применять в качестве второго постоянного полуэлемента другой электрод.Поэтому в наст.время пользуются каломельным электродом, являющимся в высшей степени точным и постоянным прибором, к-рый не приходится готовить заново перед каждым опытом, но можно Сохранять неограничершо долго. Он состоит из ртутного электрода, соприкасающегося с насыщенным раствором каломеля (HgCl) в хлористом калии (см. рисунок 1, К). Т. о., на практике только один полуэле-мепт, только электрод, погруженный в исследуемый раствор, является водородным. Однако, зная разность потенциалов между каломельным и нормальным водородным электродом, легко ввести к измеренной величине соответствующую поправку и производить все дальнейшие вычисления так же точно, как и при пользовании описанной выше полной водородной цепью.— Для других t°, а также в зависимости от барометрического давления (от к-рого зависит давление водородной атмосферы вокруг платинового электрода), необходимо вводить соответствующие поправки. Большое значение имеет также способ соединения обоих составляющих Г. ц. полуэлементов. Н==58 В месте соприкосновения двух различных растворов, вследствие неодинаково быстрой диффузии ионов противоположного знака, возникает так называемая диффузионная разность потенциалов, к-рая суммируется с лежащей в основе нашего измерения электродной разностью потенциалов. Ее удается практически полностью устранить, применяя для соединения обеих жидкостей насыщен ный раствор КС1 (ионы К и С1 имеют приблизительно одинаковую подвижность; эта соль не дает поэтому диффузионной разности потенциалов). Чтобы придать таким «электролитическим контактам» достаточную прочность, раствор КС1 нередко готовят в виде плотного студня на агар-агаре. Остальные части электрометрической установки служат для измерения разности потенциалов между водородным и каломельным электродами. Измерение производится по компенсационному методу при помощи мостика Уитстона (см. рисунок 1, R). Типы электродов. Предложено много различных конструкций водородного электрода. Следует прежде всего назвать «грушевидный электрод», имеющий удобную систему притертых кранов для пропускания через раствор водорода(см. рисунок 2). Пропускание тока водорода недопустимо в тех случаях, когда исследуемая жидкость содержит значительные количества СОа. Последняя была бы удалена током проходящего газа, что значительно сместило бы реакцию в щелочную сторону (как это действительно имело место при первых попытках электрометрического измерения реакции крови). Приходится ограничиваться возможно малым объемом водорода, в к-ром быстро устанавливается парциальное давление СОа, соответствующее ее содержанию в растворе. Электродом такого типа (пригодным для измерения рН крови) является т. н. «U-образный» электрод (см. рисунок 3). Шаде (Schade) предложил «подкожный электрод» для измерения реакции тканевого сока в живой ткани (см. рисунок 4); электрод вводится уколом под кожу. Во многих случаях приходится измерять крайне малые количества (вплоть до одной капли) исследуемой жидкости. С этой целью предложены различные микроэлектроды, примером к-рых может служить микроэлектрод Лемана (Leh-mann; см. рисунок 5) или его видоизменение по Радзимовской (см. рисунок 6).—X и н г и д-ронный электрод. В последнее время значительное распространение получил особый тип водородного электрода—т. н. хингидронный электрод, введенный Бейль-маном (Bijlman). Хингидрон представляет соединение (в эквимолярной пропорции) хинона (CjHjOu) и гидрохинона (СвЬ^СКНг). В растворе оба эти вещества находятся в равновесии, согласно уравнению: С6Н40,,Н^ ^С6Н402+Н2. Благодаря этой реакции нет надобности пропускать водород: при прибавлении к раствору небольшого количества хингидрона электроды ведут себя так, как если бы они были в равновесии с определенным (крайне низким) давлением газообразного водорода. Можно построить концентрационную цепь из двух хингидронных электродов (один из к-рых погружен в рас- твор известного рН, другой—в измеряемый) или из соединения хингидронного электрода с постоянным каломельным. Примером хингидронного электрода для малых количеств жидкости может служить шприц-электрод Мисловицера (Mislowit.zer; см. рисунок 7). В хингидронном электроде потенциал устанавливается настолько быстро, что взятая при помощи такого шприца проба крови может быть измерена прежде, чем она успеет свернуться. При щелочной реакции так же, как и при очень кислой (рН<2,5), хин-гидронные электроды неприменимы. Лит.: Михаэлис Л., Практикум физической химии, Л., 1926; С la r k W. М., Tlie determination of hydrogen ions, Baltimore, 1925; Kopaczewski W., Les ions d'bydrogene, P., 1926; M i s 1 о w i t-z e r E., Die Bestimmuns d. Wasserstoffionenkonzentra-tion von Fliissigkeiten, В.. 1928. Д. Рубинштейн. Смотрите также:
Смотрите также:
- ГАЗОВОЕ ПРОИЗВОДСТВО, заключается в получении светильного газа путем сухой перегонки углерод-содержащих веществ (каменный уголь, нефть, дерево). Англ. инженеру Мердоку (Murdoch) впервые удалось Рисунок 1. Разрез газовой печи с вертикальными ретортами: А—приемная ...
- ГАЗОВЫЕ ЧАСЫ,представляютсобойпри-бор, измеряющий объем проходящего через Вер- него газа. В исследованиях по газообмену (см.) употребляются для определения объема выдохнутого воздуха. Требования, предъявляемые к газовым часам, сводятся чаще всего к следующим: 1) ...
- ГАЗОВЫЙ АНАЛИЗ, являясь одним из отделов аналитич. химии, имеет задачей определение состава газовых смесей, напр., вдыхаемого и выдыхаемого воздуха (см. Дыхание), газов крови (см.), лимфы, кишечника и т. д. (обширное и ...
- ГАЗОГЕНЕРАТОРЫ, аппараты для превращения твердого топлива в газообразное или в т. н. генераторный газ. В отличие от простых топок сжигание топлива в Г. ведется при значительно более толстом слое горючего, ...
- ГАЗОЛИН, смесь легких жидких углеводородов удельного веса 0,60—0,68, получаемых путем перегонки из нефти. В зависимости от состава, t° кипения газолина может колебаться в пределах от 30 до 70°. Газолин как ...